उमा सुधीर विज्ञान में पढ़ाई जाने वाली कई अवधारणाओं के समान उत्तरोत्तर विकास का विचार अम्ल और क्षार की अवधारणा पर भी लागू होता है। इसका मतलब है कि हम एक ही अवधारणा से बार-बार विभिन्न स्तरों पर मुलाकात करते हैं और अपनी समझ को तराशते जाते हैं। स्कूलों में इस विषय को बहुत ही चलताऊ ढंग से पढ़ाया जाता है, उससे सम्बन्धित अवधारणाओं को गहराई से टटोलने की कोशिश करता है यह आलेख। उम्मीद है कि इससे यह समझने में मदद मिलेगी कि कैसे आयनीकरण pH का निर्धारण करता है और किसी भी जलीय घोल की pH से तय होता है कि वह अम्ल की तरह बर्ताव करेगा या क्षार की तरह।
विज्ञान में पढ़ाई जाने वाली कई अवधारणाओं के समान उत्तरोत्तर विकास का विचार अम्ल और क्षार की अवधारणा पर भी लागू होता है। इसका मतलब है कि हम एक ही अवधारणा से बार-बार विभिन्न स्तरों पर मुलाकात करते हैं और अपनी समझ को तराशते जाते हैं। स्कूलों में इस विषय को बहुत ही चलताऊ ढंग से पढ़ाया जाता है, उससे सम्बन्धित अवधारणाओं को गहराई से टटोलने की कोशिश करता है यह आलेख। उम्मीद है कि इससे यह समझने में मदद मिलेगी कि कैसे आयनीकरण pH का निर्धारण करता है और किसी भी जलीय घोल की pH से तय होता है कि वह अम्ल की तरह बर्ताव करेगा या क्षार की तरह।
मिडिल स्कूल में जब हमारा पहला परिचय अम्ल और क्षार से करवाया गया था, तब हमें यह भी बताया गया था कि धातुओं के ऑक्साइड पानी में घुलकर क्षारीय घोल बनाते हैं जबकि अधातुओं के ऑक्साइड अम्लीय घोल बनाते हैं। और हमने लिटमस कागज़ की मदद से अम्ल और क्षार की पहचान करना सीखा था। इस शुरुआती परिभाषा को तराशने की ज़रूरत होती है और अगली कक्षाओं में हम यही करते हैं।
परिभाषा का दायरा बढ़ाते मॉडल
जब यह विषय हाई स्कूल में फिर से प्रकट होता है, तो हम सीखते हैं कि अर्हीनियस ने अम्लों को ऐसे पदार्थों के रूप में  परिभाषित किया था जो घोल में H+ आयन उत्पन्न करते हैं (जैसे पानी में घोले जाने पर हायड्रोक्लोरिक अम्ल)। इसके विपरीत क्षार घोल में OH- आयन उत्पन्न करते हैं (जैसे पानी में कॉस्टिक सोडा)। इसके बाद हमारा परिचय अम्ल और क्षार को लेकर ब्रॉन्स्टेड और लॉरी के विचारों से करवाया जाता है। हमें पता चलता है कि अम्ल और क्षार, दोनों को H+ आयन के लिहाज़ से परिभाषित किया जा सकता है – अम्ल वे पदार्थ हैं जो H+ आयन देते हैं जबकि क्षार उन्हें ग्रहण करते हैं। (इस परिभाषा के मुताबिक हायड्रोक्लोरिक अम्ल तो अम्ल ही रहता है लेकिन अब आप अमोनिया को भी एक क्षार के रूप में वर्गीकृत कर सकते हैं क्योंकि यह H+ ग्रहण करके अमोनियम आयन (NH4+) बना देती है।
परिभाषित किया था जो घोल में H+ आयन उत्पन्न करते हैं (जैसे पानी में घोले जाने पर हायड्रोक्लोरिक अम्ल)। इसके विपरीत क्षार घोल में OH- आयन उत्पन्न करते हैं (जैसे पानी में कॉस्टिक सोडा)। इसके बाद हमारा परिचय अम्ल और क्षार को लेकर ब्रॉन्स्टेड और लॉरी के विचारों से करवाया जाता है। हमें पता चलता है कि अम्ल और क्षार, दोनों को H+ आयन के लिहाज़ से परिभाषित किया जा सकता है – अम्ल वे पदार्थ हैं जो H+ आयन देते हैं जबकि क्षार उन्हें ग्रहण करते हैं। (इस परिभाषा के मुताबिक हायड्रोक्लोरिक अम्ल तो अम्ल ही रहता है लेकिन अब आप अमोनिया को भी एक क्षार के रूप में वर्गीकृत कर सकते हैं क्योंकि यह H+ ग्रहण करके अमोनियम आयन (NH4+) बना देती है।
इतना होने के बाद यह तर्कसंगत ही लगता है कि बात को अम्ल व क्षार की लुई धारणा पर भी लागू कर दिया जाए। यदि हम हायड्रोजन आयन देने या लेने की बात कर सकते हैं, तो क्या यही बात इलेक्ट्रॉन के बारे में नहीं कह सकते? तो लुई अम्ल वे पदार्थ हैं जो इलेक्ट्रॉन को ग्रहण करते हैं जबकि क्षार इलेक्ट्रॉन-दाता होते हैं। आसान है, नहीं? यह ब्रॉन्स्टेड-लॉरी अवधारणा का उलट है – हायड्रोजन आयन दाता इलेक्ट्रॉन ग्राही यानी अम्ल होगा और क्षार इससे उलट।
लेख के मूल विषय यानी अम्ल-क्षार को समझने में pH की भूमिका पर आगे बढ़ने से पहले यहाँ हम संक्षेप में रासायनिक अभिक्रियाओं को समझने की दृष्टि से अम्ल-क्षार की लुई अवधारणा के निहितार्थ पर चर्चा करेंगे। एक तो हमें यह समझना चाहिए कि क्रमिक रूप से अम्ल और क्षार की हर अगली परिभाषा उन पदार्थों की सूची को विस्तार देती है जिन्हें अम्ल और क्षार के रूप में वर्गीकृत किया जा सकता है। यदि धातु और अधातु के ऑक्साइड वाली पहली परिभाषा पर लौटें तो पाएँगे कि सूची बहुत छोटी तो है ही, भ्रामक भी है क्योंकि एल्यूमिनियम और जस्ते जैसी अच्छी-अच्छी धातुएँ ऐसे ऑक्साइड बनाती हैं जो उभयधर्मी होते हैं। अर्थात वे अम्ल और क्षार, दोनों तरह से बर्ताव कर सकते हैं। और तो और, इस परिभाषा के मुताबिक हम अमोनियम हायड्रॉक्साइड को क्षार नहीं कह सकते क्योंकि स्पष्ट तौर पर यह पानी में घुला धात्विक ऑक्साइड नहीं है।
अर्हीनियस की परिभाषा अमोनियम हायड्रॉक्साइड जैसे पदार्थों को शामिल करके सूची को लम्बी बना देती है (क्योंकि अमोनियम हायड्रॉक्साइड जलीय घोल में अमोनियम आयन (NH4+) और हायड्रॉक्साइड आयन (OH-) उत्पन्न करता है)। इसके अलावा, इस परिभाषा के दम पर अर्हीनियस कुछ लवणों को भी अम्लीय (कॉपर सल्फेट – हायड्रोजन आयन ढूँढ़ो तो जानें) और क्षारीय (सोडियम कार्बोनेट – हायड्रॉक्साइड आयन ढूँढ़ते रह जाओगे) के रूप में वर्गीकृत कर पाते हैं। ये लवण जलीय विलयन में अम्लीय या क्षारीय व्यवहार दर्शाते हैं (इसकी चर्चा आगे करेंगे)।
ब्रॉन्स्टेड और लॉरी की परिभाषा पर पहुँचते हैं (जिसमें हायड्रोजन आयन दाता अम्ल और हायड्रोजन आयन ग्राही क्षार है) तो कई अन्य पदार्थों को अम्ल और क्षार की सूची में शामिल किया जा सकता है। उदाहरण के लिए अमोनिया (जिसके बारे में पहले बात की थी) प्रोटॉन ग्रहण करके अमोनियम आयन बना सकती है, लिहाज़ा अमोनिया एक क्षार है। अब यदि हम हायड्रोजन को तिलांजलि दे दें और सिर्फ इलेक्ट्रॉन की बात करें, तो किसी भी अभिक्रिया को अम्ल और क्षार के हिसाब से समझा जा सकता है। कोई भी पदार्थ जो इलेक्ट्रॉन दान कर सकता है, वह क्षार है और यदि वह इलेक्ट्रॉन को ग्रहण कर सकता है तो अम्ल है। और यह बात पदार्थ की हर अवस्था पर लागू होती है, सिर्फ जलीय विलयनों पर नहीं। तो SnCl4 जैसा कोई ठोस पदार्थ एक लुई अम्ल है। हम सारे पदार्थों को अम्ल और क्षार के रूप में वर्गीकृत करने के फायदों पर विचार फिलहाल मुल्तवी कर सकते हैं लेकिन याद रखें कि यह वर्गीकरण स्थाई हो, ऐसा ज़रूरी नहीं है। कोई पदार्थ ‘क’ एक अन्य पदार्थ ‘ख’ के साथ अम्ल की तरह व्यवहार कर सकता है लेकिन हो सकता है कि किसी तीसरे पदार्थ ‘ग’ के साथ वह क्षार जैसा बर्ताव करे। खैर, यह सब बहुत मज़ेदार तो है लेकिन हमारे इस लेख का मूल विषय नहीं है। तो ब्रॉन्स्टेड-लॉरी अम्ल-क्षार पर लौटते हैं।
अब यदि हम हायड्रोजन को तिलांजलि दे दें और सिर्फ इलेक्ट्रॉन की बात करें, तो किसी भी अभिक्रिया को अम्ल और क्षार के हिसाब से समझा जा सकता है। कोई भी पदार्थ जो इलेक्ट्रॉन दान कर सकता है, वह क्षार है और यदि वह इलेक्ट्रॉन को ग्रहण कर सकता है तो अम्ल है। और यह बात पदार्थ की हर अवस्था पर लागू होती है, सिर्फ जलीय विलयनों पर नहीं। तो SnCl4 जैसा कोई ठोस पदार्थ एक लुई अम्ल है। हम सारे पदार्थों को अम्ल और क्षार के रूप में वर्गीकृत करने के फायदों पर विचार फिलहाल मुल्तवी कर सकते हैं लेकिन याद रखें कि यह वर्गीकरण स्थाई हो, ऐसा ज़रूरी नहीं है। कोई पदार्थ ‘क’ एक अन्य पदार्थ ‘ख’ के साथ अम्ल की तरह व्यवहार कर सकता है लेकिन हो सकता है कि किसी तीसरे पदार्थ ‘ग’ के साथ वह क्षार जैसा बर्ताव करे। खैर, यह सब बहुत मज़ेदार तो है लेकिन हमारे इस लेख का मूल विषय नहीं है। तो ब्रॉन्स्टेड-लॉरी अम्ल-क्षार पर लौटते हैं।
आप सोच रहे होंगे कि हमें अम्ल-क्षार के बारे में ब्रॉन्स्टेड-लॉरी के विचारों की इतनी चिन्ता करने की क्या ज़रूरत है जबकि हमारे पास लुई द्वारा दिया गया ज़्यादा परिष्कृत सिद्धान्त उपलब्ध है। इस बिन्दु पर यह देखना ज़रूरी है कि एक ज़्यादा समावेशी सिद्धान्त अपने पहले दिए गए अपेक्षाकृत सीमित सिद्धान्त (जैसे ब्रॉन्स्टेड-लॉरी सिद्धान्त) को गलत साबित नहीं करता। नया सिद्धान्त सिर्फ इतना करता है कि पुराने सिद्धान्त के लागू होने की सीमाएँ निर्धारित कर देता है। इन सीमाओं के बाहर हमें प्राय: ज़्यादा जटिल सिद्धान्त को लागू करना पड़ता है। इसलिए, कई मामलों में अम्ल-क्षार को समझने के लिए ब्रॉन्स्टेड-लॉरी के विचार मददगार साबित होते हैं। अत: हम यहाँ ऐसी कुछ चीज़ समझने की कोशिश करेंगे जो रसायन शास्त्र के कई विद्यार्थियों को मुश्किल जान पड़ती है – प्रबल अम्ल और प्रबल क्षार क्या होते हैं? प्रबल क्षार-अम्ल और सान्द्र अम्ल-क्षार में क्या अन्तर होता है? वह क्या है जो किसी पदार्थ को दुर्बल क्षार बना देता है, चाहे उसका सान्द्र घोल ही क्यों न ले लिया जाए? और इन सवालों का जवाब खोजते हुए हम pH की भूमिका पर भी चर्चा करेंगे। (संदर्भ अंक 4, पृष्ठ 30, सुशील जोशी का लेख ‘दो तरह की अम्लीयता, क्षारीयता' भी देखें।)
अत: हम यहाँ ऐसी कुछ चीज़ समझने की कोशिश करेंगे जो रसायन शास्त्र के कई विद्यार्थियों को मुश्किल जान पड़ती है – प्रबल अम्ल और प्रबल क्षार क्या होते हैं? प्रबल क्षार-अम्ल और सान्द्र अम्ल-क्षार में क्या अन्तर होता है? वह क्या है जो किसी पदार्थ को दुर्बल क्षार बना देता है, चाहे उसका सान्द्र घोल ही क्यों न ले लिया जाए? और इन सवालों का जवाब खोजते हुए हम pH की भूमिका पर भी चर्चा करेंगे। (संदर्भ अंक 4, पृष्ठ 30, सुशील जोशी का लेख ‘दो तरह की अम्लीयता, क्षारीयता' भी देखें।)
आयन आधारित मॉडल
सबसे पहले यह देखते हैं कि अर्हीनियस किन चीज़ों के साथ काम कर रहे थे। अब हम इस बात से तो वाकिफ हैं कि अमोनियम हायड्रॉक्साइड NH4+ और OH- आयनों में टूट जाता है। लेकिन ध्यान रखें कि अर्हीनियस के सिद्धान्त से पहले हमारे पास अमोनियम हायड्रॉक्साइड का मात्र अणु सूत्र (एम्पिरिकल सूत्र) था – NH5O - और यह पता था कि अमोनियम हायड्रॉक्साइड के जलीय विलयन में विद्युत प्रवाहित होती है। क्या इससे कोई सुराग मिलता है कि अमोनियम हायड्रॉक्साइड दो विपरीत आवेशों वाले हिस्सों में टूट रहा होगा, और ये दो हिस्से क्या होंगे और, इन पर विपरीत आवेश क्यों होते होंगे? आज हम जिन आयनों की उपस्थिति को मानकर चलते हैं, उनकी सूची तक पहुँच पाना आसान नहीं था हालाँकि, यह सूची विभिन्न पदार्थों की चालकता के अध्ययन और लगनपूर्वक उनकी तुलना करके विकसित हुई थी। अर्हीनियस ने आयनिक पदार्थों के विलयनों की चालकता का अध्ययन किया और यह निष्कर्ष निकाला कि आयनिक पदार्थ दो भागों में टूटते होंगे – एक भाग पर धनावेश होता होगा और दूसरे भाग पर बराबर मात्रा में ऋणावेश। इस प्रकार से घोल कुल मिलाकर उदासीन रहता है जबकि वह विद्युत का सुचालक होता है। प्रत्येक आयन का आवेश और प्रत्येक पदार्थ में आयनों की साइज़ अलग-अलग होते हैं। अर्हीनियस ने विभिन्न विलयनों द्वारा प्रवाहित विद्युत की मात्रा का अध्ययन करके यह पता लगाया कि ये अलग-अलग आयन क्या हो सकते हैं। एक निश्चित मात्रा में आवेश का वाहक छोटा आयन ज़्यादा विद्युत ढोएगा बनिस्बत उतने ही आवेश वाले किसी बड़े आयन के। कारण यह है कि विलयन में उपस्थित अन्य आयन तथा अणु बड़े आयन की गति में ज़्यादा अवरोध उत्पन्न करेंगे।
इसका मतलब क्या है? कल्पना कीजिए कि कोई धनावेशित आयन जलीय विलयन में गति कर रहा है। वह ऋण इलेक्ट्रोड (ऋणोद) की ओर जाएगा। इस दौरान उसे कई अवरोधों का सामना करना होगा क्योंकि उसे पानी के अणुओं के बीच से होकर यात्रा करनी होगी। यदि हम किसी घोल में गति करते H+ आयन और Na+ आयन की तुलना करें तो यह देखना आसान है कि सोडियम आयन बड़ा होने की वजह से धीमी गति से आगे बढ़ेगा। लिहाज़ा, यदि किसी घोल में बराबर मात्रा में दो अलग-अलग साइज़ के आयन हों तो उस घोल में से ज़्यादा धारा बहेगी जिसमें आयन छोटे हैं (यह मानकर कि दोनों घोलों पर बराबर विभवान्तर आरोपित किया गया है)। और यदि हम सोडियम और मैग्नीशियम आयनों की चालकता की बात करें, जो दोनों लगभग बराबर साइज़ के हैं लेकिन सोडियम आयन के मुकाबले मैग्नीशियम आयन पर दुगना आवेश होता है, इसलिए सोडियम आयन वाले घोल की तुलना में मैग्नीशियम आयन वाले घोल में ज़्यादा धारा बहेगी (बशर्ते कि दोनों पर एक बराबर विभवान्तर लगाया जाए)। एक बात यह भी है कि ये सारे अध्ययन तनु विलयनों पर किए गए थे ताकि धनावेशित कणों की गति में ऋणावेशित कणों के आकर्षण की वजह से बहुत ज़्यादा असर न पड़े। घोल में तो दोनों ही प्रकार के आयन होंगे।
एक बार जब पदार्थों के टूटकर विपरीत आवेशों वाले आयन बनने की बात स्वीकार कर ली गई, तो आगे काम किया गया जिसका मकसद था विलयन अवस्था में विभिन्न पदार्थों के व्यवहार का अध्ययन। इसके अन्तर्गत विभिन्न अम्लों एवं क्षारों का भी अध्ययन किया गया। सवाल यह था कि यदि सारे अम्ल हायड्रोजन आयन उत्पन्न करते हैं और सारे क्षार हायड्रॉक्साइड उत्पन्न करते हैं तो फिर सारे अम्ल/क्षार हूबहू एक जैसे क्यों नहीं होते। अम्ल और क्षार में जो ऋणावेशित/धनावेशित आयन होता है, उसके कारण क्या फर्क पड़ता है?
विलायक की भूमिका और महत्व
ये अध्ययन चलते-चलते, कुछ बातें स्पष्ट हो गईं। एक तो हम गैर-जलीय विलयनों का भी अध्ययन कर सकते हैं। लेकिन उसी पदार्थ के अन्य विलायकों (जैसे एथेनॉल) में तैयार किए गए घोल में अन्तर होते हैं। यानी अम्लीय और क्षारीय शक्ति विलायक पर निर्भर होती है। हो सकता है कि जो पदार्थ पानी में घोलने पर शक्तिशाली अम्लीय घोल दे, वह किसी अन्य विलायक में शायद उतना अम्लीय न हो। इसलिए विलायक की भूमिका समझना ज़रूरी हो गया। इसके अलावा, यह भी देखा गया कि सान्द्र घोलों के गुणधर्मों का पूर्वानुमान तनु घोलों के गुणधर्मों को आगे बढ़ाकर नहीं लगाया जा सकता। सारे पदार्थ अम्लीयता और क्षारीयता के लिहाज़ से तनु घोलों में काफी पूर्वानुमानित ढंग से व्यवहार करते हैं लेकिन थोड़े-से भी सान्द्र घोल में वे अन्तर नज़र आने लगते हैं जिन्हें प्रबल अम्ल या प्रबल क्षार से जुड़ा माना जाता है।
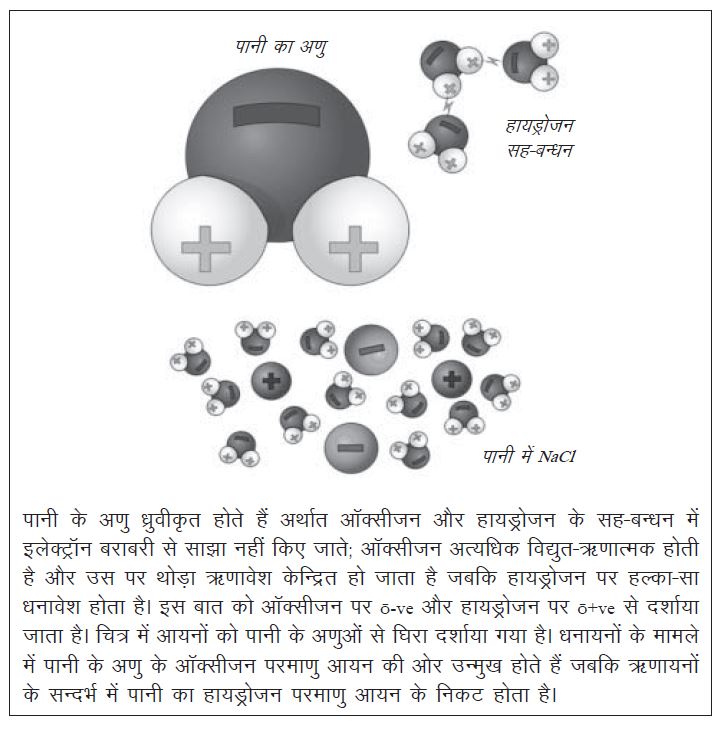 अम्लीय या क्षारीय शक्ति की बात को गहराई से देखने से पहले विलायक की मात्रा और उसकी प्रकृति की यह भूमिका संक्षेप में समझ लेना ज़रूरी है। (सम्बन्धित पठन सामग्री – संदर्भ अंक 68, पृष्ठ 29, सुशील जोशी का लेख ‘आसान नहीं है घुलने-मिलने को समझना')। विलायक महत्वपूर्ण क्यों है? जब किसी आयनिक पदार्थ को पानी में घोला जाता है, तो न सिर्फ आयन अलग-अलग हो जाते हैं बल्कि पानी के अणु उन्हें घेर भी लेते हैं। इस मामले में पानी के अणु की ध्रुवीय प्रकृति एक अहम भूमिका निभाती है क्योंकि धनायन को स्थिरता मिलती है जब पानी के अणु के तनिक ऋणावेशित ऑक्सीजन परमाणु उसके आसपास होते हैं और ऋणायनों को स्थिरता मिलती है जब पानी के अणु के तनिक धनावेशित हायड्रोजन परमाणु उन्हें घेर लेते हैं।
अम्लीय या क्षारीय शक्ति की बात को गहराई से देखने से पहले विलायक की मात्रा और उसकी प्रकृति की यह भूमिका संक्षेप में समझ लेना ज़रूरी है। (सम्बन्धित पठन सामग्री – संदर्भ अंक 68, पृष्ठ 29, सुशील जोशी का लेख ‘आसान नहीं है घुलने-मिलने को समझना')। विलायक महत्वपूर्ण क्यों है? जब किसी आयनिक पदार्थ को पानी में घोला जाता है, तो न सिर्फ आयन अलग-अलग हो जाते हैं बल्कि पानी के अणु उन्हें घेर भी लेते हैं। इस मामले में पानी के अणु की ध्रुवीय प्रकृति एक अहम भूमिका निभाती है क्योंकि धनायन को स्थिरता मिलती है जब पानी के अणु के तनिक ऋणावेशित ऑक्सीजन परमाणु उसके आसपास होते हैं और ऋणायनों को स्थिरता मिलती है जब पानी के अणु के तनिक धनावेशित हायड्रोजन परमाणु उन्हें घेर लेते हैं।
इसके अलावा, विपरीत आवेश वाले आयन एक-दूसरे को आकर्षित करेंगे और आपस में जोड़ियाँ बनाने की कोशिश करेंगे। इसलिए यह ज़रूरी होता है कि आयनों को एक-दूसरे से यथासम्भव दूर से दूर रखा जाए। इसलिए आयनीकरण तब ज़्यादा होता है जब आयनों को पानी से हायड्रेशन के द्वारा स्थिरता मिल जाती है। घोल तनु होता है (यानी विलायक की मात्रा तुलनात्मक रूप से अधिक होती है) तब भी आयनीकरण की प्रक्रिया में वृद्धि होती है। अर्थात किसी आयनिक पदार्थ से विपरीत आवेशित आयनों के निर्माण को निम्नलिखित उत्क्रमणीय प्रक्रिया के रूप में समझा जा सकता है:
AB ⇌ A+ + B-
जिसमें साम्यावस्था तब दाईं ओर चली जाती है जब A+ और B- को हायड्रेशन द्वारा स्थिरता मिल जाए और तनु घोल में वे दूर-दूर रहें। हायड्रेशन में मुक्त ऊर्जा यानी विलायक के अणु से घेरे जाने की वजह से आयनों का स्थिरीकरण विलायक की प्रकृति पर निर्भर है। विलायक जितना अधिक ध्रुवीकृत होगा (पानी एक अच्छा उदाहरण है), आयनों का स्थिरीकरण उतना ही अधिक होगा। यदि हम एथेनॉल जैसा कोई कम ध्रुवीकृत विलायक लें तो एथेनॉल अणुओं से घेरे जाने की वजह से स्थिरीकरण पानी की तुलना में कम होगा। इस लेख में हम सिर्फ जलीय विलयनों की बात करेंगे।
आयनों की प्रकृति पर निर्भरता
शेष लेख में हम आयनों की प्रकृति पर विचार करेंगे। क्योंकि स्थिरीकरण की मात्रा आयनों की प्रकृति पर भी तो निर्भर करेगी। ऐसा क्यों? जब कोई धनावेशित आयन (जैसे H+ या Na+ या Mg2+) पानी में जाता है, तो तत्काल उसे पानी के अणु घेर लेते हैं। ध्रुवीकृत होने के कारण पानी के अणु आयनों के आवेश से आकर्षित होते हैं। आकर्षण कितना शक्तिशाली होता है, यह दो बातों पर निर्भर करता है – आयन पर आवेश की मात्रा और आयन की साइज़। यदि आयनों की साइज़ अपेक्षाकृत एक जैसी हो (जैसे Na+ और Mg2+ के मामले में), तो Mg2+ आयन पर ज़्यादा आवेश के चलते पानी के अणु Mg2+ के प्रति ज़्यादा आकर्षित होंगे। और यदि दो आयनों पर एक बराबर आवेश हो (जैसे Na+ और K+ के मामले में), तो सोडियम आयन ज़्यादा हायड्रेट होगा क्योंकि वह छोटा है और उसका आवेश-संहति (या आवेश-आयतन) अनुपात कम होगा। यानी कोई आयन विलयन में कितना स्थिर रहेगा, यह जानने के लिए हमें बस उसके आवेश और साइज़ का ज्ञान होना चाहिए।
जब हम पदार्थों को पानी में घोलेंगे तो इसका आशय क्या होगा? उदाहरण के लिए, जब हम HCl या NaOH को पानी में घोलते हैं तो ये निम्नानुसार वियोजित होते हैं:
HCl ⇌ H+ + Cl-
NaOH ⇌ Na+ + OH-
|
विलयन की सान्द्रता को व्यक्त करने का तरीका जब एक मोल (ग्राम अणु भार यानी ग्राम में व्यक्त अणु भार, जैसे 40 ग्राम सोडियम हायड्रॉक्साइड) पदार्थ को इतने विलायक में घोला जाए कि 1 लीटर घोल बन जाए तो हमें 1 मोलर विलयन प्राप्त होता है। ध्यान दें कि हमें 1 मोलर घोल 1 मोल पदार्थ को 1 लीटर विलायक में घोलकर प्राप्त नहीं होता। यह एक महत्वपूर्ण अन्तर है। हम सब जानते हैं कि 342 ग्राम शक्कर (सुक्रोज़ का अणु भार 342 है) को 1 लीटर पानी में घोलें तो हमें 1 लीटर से थोड़ा अधिक घोल मिलेगा। 1 लीटर घोल में किसी पदार्थ के कितने मोल घुले हैं, इसे दर्शाने वाली इकाई को मोलेरिटी कहते हैं। |
इन दो मामलों में, सारे आयनों का पानी के अणुओं द्वारा काफी अधिक स्थिरीकरण होता है, और साम्यावस्था इतनी दाईं ओर होती है कि हम मान सकते हैं कि तनु विलयन (जहाँ आयन दूर-दूर होते हैं और विपरीत आवेश के कारण आकर्षित होकर वापिस नहीं जुड़ पाते) में सारे के सारे HCl और NaOH के अणु वियोजित अवस्था में हैं।
लेकिन एसिटिक अम्ल को पानी में घोलने पर क्या होता है? समीकरण निम्नानुसार लिखी जा सकती है
CH3COOH ⇌ CH3COO- + H+ यहाँ एसिटेट आयन काफी बड़ा है, जिस पर इकहरा ऋणावेश है। इसका मतलब है कि यह पानी के अणुओं द्वारा हायड्रेशन की वजह से उतना स्थिरीकृत नहीं होता। चूँकि CH3COO- पानी में बहुत स्थिर आयन नहीं है, इसलिए यह लौटकर CH3COOH बना लेना ‘चाहता’ है। तो इस मामले में, साम्यावस्था काफी बाईं ओर होती है और आपको घोल में बहुत अधिक आयन नहीं मिलेंगे। हम यह बात कैसे जानते हैं? यदि हम एसिटिक अम्ल और हायड्रोक्लोरिक अम्ल के बराबर सान्द्रता (मान लीजिए 0.1 N) घोल लें और HCl के सारे अणु वियोजित हों जबकि एसिटिक अम्ल के न हों, तो हम दो अवलोकन कर सकते हैं।
यहाँ एसिटेट आयन काफी बड़ा है, जिस पर इकहरा ऋणावेश है। इसका मतलब है कि यह पानी के अणुओं द्वारा हायड्रेशन की वजह से उतना स्थिरीकृत नहीं होता। चूँकि CH3COO- पानी में बहुत स्थिर आयन नहीं है, इसलिए यह लौटकर CH3COOH बना लेना ‘चाहता’ है। तो इस मामले में, साम्यावस्था काफी बाईं ओर होती है और आपको घोल में बहुत अधिक आयन नहीं मिलेंगे। हम यह बात कैसे जानते हैं? यदि हम एसिटिक अम्ल और हायड्रोक्लोरिक अम्ल के बराबर सान्द्रता (मान लीजिए 0.1 N) घोल लें और HCl के सारे अणु वियोजित हों जबकि एसिटिक अम्ल के न हों, तो हम दो अवलोकन कर सकते हैं।
सबसे पहली बात तो यह है कि यदि हम इन दोनों घोलों पर बराबर वोल्टेज लगाएँ (यह सावधानी रखते हुए कि इलेक्ट्रोड्स के बीच की दूरी बराबर और बाकी परिस्थितियाँ भी एक जैसी हैं), तो HCl घोल द्वारा वाहित धारा एसिटिक अम्ल के घोल द्वारा वाहित धारा से ज़्यादा होगी। (यानी परिपथ में लगा बल्ब पहले मामले में ज़्यादा प्रकाश देगा; या चाहें तो एमीटर की मदद से धारा को नाप भी सकते हैं।) दूसरी, कि दोनों घोलों की pH एक बराबर नहीं होगी। हम थोड़ी देर में बात करेंगे कि pH होती क्या है। लेकिन उससे पहले यह चर्चा करते हैं कि विभिन्न पदार्थों के वियोजन में सान्द्रता की क्या भूमिका होती है।
हम यह कैसे सुनिश्चित कर सकते हैं कि घोल में सारा-का-सारा एसिटिक अम्ल वियोजित अवस्था में हो। यह सुनिश्चित करने के लिए हम यह कर सकते हैं कि किसी एसिटेट आयन की ‘मुलाकात’ हायड्रोजन आयन से न हो पाए। अन्यथा ये दोनों जुड़कर वापिस एसिटिक अम्ल का अणु बना लेंगे। संक्षेप में कहें, तो एसिटिक अम्ल के मामले में पूर्ण वियोजन अत्यन्त तनु घोल में ही होगा।
प्रबल और दुर्बल अम्ल-क्षार
प्रबल और दुर्बल अम्ल या क्षार के बीच मूल अन्तर यही है। कोई प्रबल अम्ल या क्षार किसी दुर्बल अम्ल या क्षार की अपेक्षा काफी पहले ही पूर्ण वियोजित हो जाएगा। मैंने ‘काफी पहले’ शब्दों का उपयोग क्यों किया? क्योंकि सान्द्र घोलों में तो प्रबल अम्ल और क्षार भी पूर्ण वियोजित अवस्था में नहीं होंगे। अर्थात यदि हम बाज़ार में उपलब्ध सान्द्र हायड्रोक्लोरिक अम्ल या गन्धक का अम्ल लें तो सारे अणु वियोजित रूप में नहीं होंगे। लेकिन 1 N घोल में वे पूर्ण रूप से वियोजित रूप में मिलेंगे। और जब हम दुर्बल अम्ल या क्षार की बात करते हैं तो उनके 1N घोल में भी बहुत कम अणु वियोजित स्थिति में होंगे।
अर्थात, यदि हम हायड्रोक्लोरिक अम्ल और एसिटिक अम्ल के 1-1 N घोल लें तो हायड्रोक्लोरिक अम्ल के घोल में H+ आयन बहुत अधिक संख्या में होंगे। कहना न होगा कि इन दोनों घोलों में क्रमश: Cl- आयन और CH3COO- आयन भी उतनी ही मात्रा में होंगे। इसे कैसे नापते हैं। हम जानते हैं कि यदि हम सोडियम हायड्रॉक्साइड के मानक विलयन के साथ अनुमापन करेंगे, तो 20 मि.ली. 0.1 N हायड्रोक्लोरिक अम्ल को उदासीन करने में सोडियम हायड्रॉक्साइड घोल की उतनी ही मात्रा लगेगी जितनी 20 मि.ली. 0.1 N एसिटिक अम्ल के घोल के लिए लगती है।
अनुमापन हमें सिर्फ यह बताता है किसी घोल में कुल कितना अम्ल उपस्थित है; इससे यह पता नहीं चलता कि किसी समय पर कितना अम्ल वियोजित अवस्था में है। ऐसा क्यों? जब हम एसिटिक अम्ल के घोल में सोडियम हायड्रॉक्साइड डालते हैं, तो वियोजित अवस्था में मौजूद H+ आयन सोडियम हायड्रॉक्साइस से उत्पन्न OH- आयनों से जुड़ जाते हैं (उदासीनीकरण यही तो है)। और जब H+ आयन की खपत होने लगती है तो प्रारम्भिक साम्यावस्था दाईं ओर खिसकने लगती है, ज़्यादा एसिटिक अम्ल वियोजित होकर H+ आयन देने लगता है। इस तरह से, धीरे-धीरे सारा एसिटिक अम्ल वियोजित हो जाता है और सोडियम हायड्रॉक्साइड से क्रिया कर लेता है। यदि सावधानीपूर्वक अनुमापन किया जाए तो इस बात का अवलोकन किया जा सकता है। आइए देखते हैं।
सोडियम हायड्रॉक्साइड, हायड्रो-क्लोरिक अम्ल और एसिटिक अम्ल के 0.1 N घोल बनाइए। ज़रूरी नहीं कि ठीक-ठीक 0.1 N घोल बनाए जाएँ, लगभग बराबर सान्द्रता होगी तो चलेगा। इस बात की जाँच अनुमापन से कर सकते हैं। यदि एकदम सटीक सान्द्रता के घोल बना सकें तो बनाइए, अनिवार्य नहीं है।
अब हायड्रोक्लोरिक अम्ल के घोल की 20 बूंदें एक परखनली में लीजिए और एकाध बूंद फिनॉफ्थलीन घोल की डाल दीजिए। बूंद-बूंद करके सोडियम हायड्रॉक्साइड डालिए और बीच-बीच में परखनली को हिलाते रहिए। आप देखेंगे कि जब घोल के क्षारीय हो जाने के कारण गुलाबी रंग प्रकट होता है, तो वह स्थाई होता है; अर्थात पिछली बूंद डालने से हो सकता है कि आपको हल्का गुलाबी रंग मिले जो तुरन्त गायब हो जाए। लेकिन अन्तिम बूंद डालने पर चटख गुलाबी रंग मिलेगा जो गायब नहीं होगा। (घोलों की सान्द्रता लगभग बराबर है, यह सुनिश्चित करने के लिए देख लें कि गुलाबी रंग 18-22 बूंदें डालने के बाद आए, 10 या 30 बूंद डालने पर नहीं।)
यही प्रक्रिया परखनली में 20 बूंद एसिटिक अम्ल लेकर दोहराएँ। पहले की ही तरह एकाध बूंद फिनॉफ्थलीन की डालें और सोडियम हायड्रॉक्साइड के साथ अनुमापन करें। इस मामले में, पहली बार गुलाबी रंग प्रकट होने के बाद एक और बूंद सोडियम हायड्रॉक्साइड डालने पर स्थाई गुलाबी रंग नहीं आता। बल्कि होता यह है कि 12-15 बूंद डाल देने के बाद (यह मानकर कि घोल लगभग बराबर सान्द्रता के हैं) गुलाबी रंग दिखने लगता है जो परखनली को हिलाने से गायब हो जाता है। अगली कूछ बूंदें डालने पर बार-बार गुलाबी रंग प्रकट होकर गायब होता रहता है। तो पहली बार गुलाबी रंग दिखने के बाद स्थाई रंग आने के बीच आपको पाँच-एक बूंदें डालना पड़ती हैं तब जाकर स्थाई रंग आता है जो अनुमापन का अन्तिम बिन्दु दर्शाता है।
ऐसा इसलिए होता है कि शुरुआत में एसिटिक अम्ल का वियोजन सम्पूर्ण नहीं होता। जब पहली बार गुलाबी रंग प्रकट होता है तो वह इसलिए कि डाला गया सोडियम हायड्रॉक्साइड उपलब्ध H+ आयनों से क्रिया कर लेता है और घोल में अतिरिक्त OH- आयन होते हैं और घोल क्षारीय होता है। इसके बाद अब अवियोजित एसिटिक अम्ल का वियोजन होता है जिससे और H+ आयन पैदा होते हैं जो OH- आयनों से क्रिया करते हैं और गुलाबी रंग को उड़ा देते हैं। हर बार सोडियम हायड्रॉक्साइड डालने पर एसिटिक अम्ल के वियोजन की क्रिया अधिक-से-अधिक दाईं ओर सरकती है, और अन्तत: पूरा-का-पूरा एसिटिक अम्ल वियोजित हो जाता है और सारे H+ आयन OH- आयनों से क्रिया कर लेते हैं, और अन्त में जब अतिरिक्त OH- आयन घोल में रह जाते हैं तब घोल स्थाई रूप से गुलाबी हो जाता है।
प्रबल-दुर्बल का भेद करते सूचक
विभिन्न पदार्थों के तनु विलयनों के लिटमस और हल्दी कागज़ पर असर का सावधानीपूर्वक अवलोकन भी प्रबल-दुर्बल अम्ल और क्षार के बीच अन्तर बता सकते हैं। जब हम विभिन्न विलयनों को अम्लीय, क्षारीय व उदासीन में समूहीकृत करने के लिए नीले और लाल लिटमस कागज़ पर तथा हल्दी कागज़ पर उनके असर को जाँचते हैं, तब हम दुर्बल और प्रबल अम्ल/क्षार के बीच अन्तर को आसानी-से देख सकते हैं। हायड्रोक्लोरिक अम्ल जैसा प्रबल अम्ल नीले लिटमस को फौरन गहरे लाल रंग में बदल देता है जबकि दुर्बल अम्ल (जैसे नींबू का रस जिसका उपयोग स्कूलों में यह परीक्षण करवाने के लिए किया जाता है) धीमे-धीमे परिवर्तन करेगा और बदला हुआ रंग सुर्ख लाल की बजाय बैंगनी-सा होगा। इसी प्रकार से लाल लिटमस के साथ भी साबुन का घोल (या खाने के सोडा का घोल) जो परिवर्तन लाएगा, वह उतना स्पष्ट नहीं होगा जितना कि सोडियम हायड्रॉक्साइड के साथ दिखेगा। साबुन या खाने के सोडा के घोल के साथ रंग परिवर्तन धीमे-धीमे होगा और बदला हुआ रंग नीला नहीं बल्कि बैंगनी-सा रहेगा।
तो प्रबल और दुर्बल अम्ल/क्षार के बीच यही अन्तर है – कि किस हद तक उनके अणु विलयन में वियोजित अवस्था में होते हैं। इसे कैसे नापा जाए?
pH पैमाना - क्यों और कैसे?
सोरेन्सन ने pH पैमाने का जुगाड़ तनु घोलों में अम्ल और क्षार, दोनों की शक्ति बताने के लिए किया था। सोरेन्सन का पैमाना 0 से 14 के बीच फैला है और यह हमें तनु घोलों की pH बताता है – ऐसे घोल जिनकी सान्द्रता 1N या उससे कम हो।
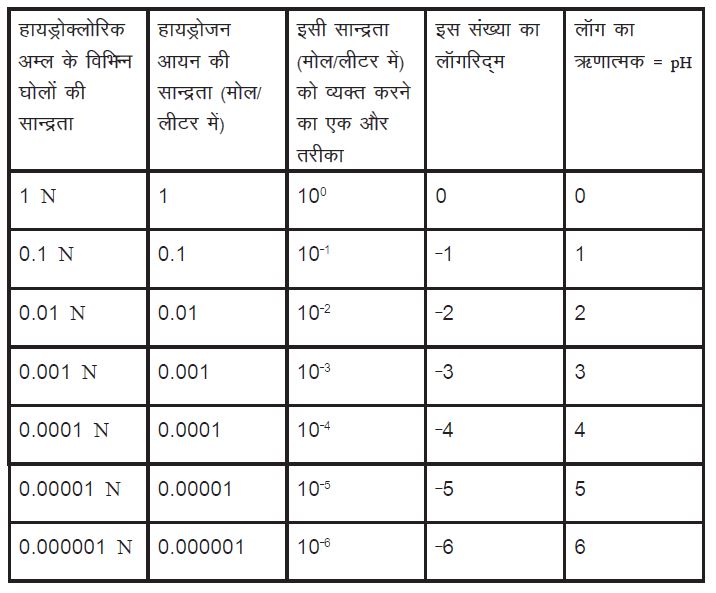
तो pH क्या है? हम सब pH की परिभाषा जानते हैं – pH तनु घोलों में हायड्रोजन आयन सान्द्रता (मोल प्रति लीटर में) का ऋणात्मक लॉग होती है। सवाल है कि लॉग क्यों और ऋणात्मक क्यों। संक्षेप में, ऐसा इस पैमाने को आसानी-से व्यक्त करने और काम को सहज बनाने के लिए है। आसानी-से व्यक्त करने की बात तो समझ में आती है लेकिन काम को सहज बनाने से क्या तात्पर्य है? इसका सम्बन्ध इस बात से है कि हम ऋणात्मक संख्याओं के साथ काम करने से कतराते हैं। (गौरतलब है कि फैरनहाइट ने तापमान के अपने पैमाने में बर्फ के गलनांक यानी पानी के हिमांक के लिए अजीब-सा मान सिर्फ इसलिए चुना था ताकि उनके शहर का तापमान कभी शून्य से कम यानी ऋणात्मक न हो।) और आसानी की बात इसलिए महत्वपूर्ण है क्योंकि सान्द्रताओं के जिस परास की हम बात कर रहे हैं, वह सचमुच विशाल है। इसलिए दशमलव के बाद ढेर सारे शून्य लिखने (याद रखें, हम तनु घोलों की बात कर रहे हैं) की बजाय सान्द्रताओं को दस के घात के रूप में लिखना कहीं अधिक आसान है। निम्नलिखित तालिका से आपको मेरी बात समझने में मदद मिलेगी।
 इस सरल और सीधी विधि का उपयोग अपेक्षाकृत सान्द्र घोलों की हायड्रोजन आयन सान्द्रता पता करने के लिए सीधे-सीधे नहीं किया जा सकता। इसके लिए हमें यह पता होना चाहिए कि सान्द्र घोलों में वियोजन का परिमाण कितना है क्योंकि हम प्रबल अम्ल/क्षार के बारे में भी यह मानकर नहीं चल सकते कि सान्द्र घोल में वे पूरी तरह वियोजित हो जाते हैं।
इस सरल और सीधी विधि का उपयोग अपेक्षाकृत सान्द्र घोलों की हायड्रोजन आयन सान्द्रता पता करने के लिए सीधे-सीधे नहीं किया जा सकता। इसके लिए हमें यह पता होना चाहिए कि सान्द्र घोलों में वियोजन का परिमाण कितना है क्योंकि हम प्रबल अम्ल/क्षार के बारे में भी यह मानकर नहीं चल सकते कि सान्द्र घोल में वे पूरी तरह वियोजित हो जाते हैं।
अब देखते हैं कि क्षारीय घोल की pH से क्या आशय होता है। यह कैसे सम्भव है कि क्षारीय घोल की शक्ति को भी उस में उपस्थित हायड्रोजन आयनों की सान्द्रता के रूप में बताया जा सके? क्या क्षारीय घोल में हायड्रोजन आयन होते हैं? यदि ऐसा है तो फिर वह क्षारीय कैसे है? यह सवाल हमें पानी नामक दिलचस्प पदार्थ के एक गुणधर्म पर ले आता है। हम जानते हैं कि पानी उदासीन होता है; न तो अम्लीय, न क्षारीय। और हमें यह भी बताया गया है कि पानी की pH 7 होती है। यह कहाँ से आई? ऐसा इसलिए है क्योंकि पानी के अणु भी वियोजित होते हैं, हालाँकि बहुत कम मात्रा में। पानी के वियोजन से H+ और OH- आयन बनते हैं:
H2O ⇌ H+ + OH-
इस वियोजन का परिमाण कई बातों पर निर्भर करता है। मुख्य कारक तापमान है। तापमान जितना अधिक होगा, वियोजन भी उतना ही अधिक होगा। अलबत्ता, किसी भी समय साम्यावस्था काफी बाईं ओर होती है, यानी किसी भी परिस्थिति में पानी के बहुत थोड़े-से अणु वियोजित अवस्था में होते हैं। और पानी उदासीन इसलिए होता है कि जब पानी का अणु वियोजित होता है तो बराबर संख्या में H+ और OH- आयन बनते हैं। 25 डिग्री सेल्सियस पर 1 लीटर पानी में 0.0000001 मोल H+ और 0.0000001 मोल OH- आयन होते हैं। यह देखना आसान है कि पानी की pH 7 होती है।
उदासीन, गैर-आयनिक पानी (यानी 25 डिग्री सेल्सियस पर शुद्ध पानी) में OH- और H+ आयनों की सान्द्रता (मोल/लीटर में) के गुणनफल (अर्थात [0.0000001] x [0.0000001] = 10-14) को पानी का आयन गुणनफल कहते हैं। रोचक बात यह है कि जब पानी में अतिरिक्त H+ या OH- आयन डाले जाते हैं तो इस मान को स्थिर रखने के लिए पानी के वियोजन की साम्यावस्था बाईं ओर खिसक जाती है। अर्थात अम्ल और क्षार के जलीय विलयनों में भी पानी का आयनिक गुणनफल 10-14 ही बना रहता है।
|
इस संख्या का मतलब क्या है? 1 लीटर पानी में पानी के 0.0000001 मोल अणु वियोजित होते हैं। 1 मोल पानी का वज़न 18 ग्राम होता है। अब चूँकि पानी का घनत्व (25 डिग्री सेल्सियस पर) 1 ग्राम/लीटर है, तो 1 मोल पानी का आयतन होगा 18 मि.ली.। 1 लीटर पानी यानी 1000 मि.ली. पानी यानी 1000/18 मोल। यह आता है 55.555 मोल। इसमें से 0.0000001 मोल अणु वियोजित हैं। यह संख्या बहुत छोटी है यानी पानी में हायड्रोजन आयन (और उतनी संख्या में हायड्रॉक्साइड आयन) की संख्या बहुत कम होती है। |
अब देखते हैं कि पानी में किसी क्षार (जैसे NaOH) के मामले में यह कैसे काम करेगा। सोडियम हायड्रॉक्साइड एक प्रबल क्षार है, तो 0.1N घोल में वह पूरा-का-पूरा वियोजित अवस्था में रहेगा। इससे हमें घोल में 0.1 मोल प्रति लीटर OH- आयन मिलेंगे। अत: H+ आयन और OH- आयन के गुणनफल में क्षार से उत्पन्न OH- आयन भी शामिल हो जाएँगे। इस प्रकार, हमारे पास पानी के स्व-वियोजन से प्राप्त 0.0000001 मोल प्रति लीटर OH- आयन हैं और सोडियम हायड्रॉक्साइड के वियोजन से प्राप्त 0.1 मोल प्रति लीटर OH-आयन हैं। चूँकि 0.0000001<<0.1 से, इसलिए हम पानी के वियोजन से प्राप्त OH- आयनों को नगण्य मानकर अनदेखा कर सकते हैं। तो OH- आयन की सान्द्रता 0.1 मोल प्रति लीटर होगी। लेकिन [H+] [OH-] (पानी का आयन गुणनफल) हमेशा 10-14 होता है। ऐसा हो पाता है क्योंकि विलयन में उपस्थित अतिरिक्त OH- आयन H+ आयनों (पानी के वियोजन से उत्पन्न) से जुड़कर पानी के अणु बना लेते हैं। इस प्रकार से H+ आयनों की सान्द्रता कम हो जाती है। हम गणना कर सकते हैं कि इस परिस्थिति में H+ आयन की सान्द्रता घटकर 0.0000000000001 मोल प्रति लीटर रह जाती है। यानी 0.1N NaOH घोल की pH 13 होगी। इसी प्रकार से 0.01N NaOH घोल की pH 12 आएगी। यह गणना कीजिए कि 0.001N और 0.00001N घोलों की pH क्या होगी।
pH की गणना करते हुए हम पानी के वियोजन से प्राप्त H+ आयनों के योगदान को उस स्थिति में अनदेखा कर देते हैं जब इनकी मात्रा अम्ल द्वारा उत्पन्न H+ आयनों से बहुत कम हो। लेकिन 6-8 pH की रेंज में पानी के वियोजन से प्राप्त H+ आयन की मात्रा को नगण्य नहीं माना जा सकता और pH की गणना में इसका भी हिसाब रखना होता है। और pH के पैमाने पर 7 से कम का मान अम्लीय घोल का द्योतक होता है, 7 उदासीन घोल का तथा 7 से अधिक मान क्षारीय घोल दर्शाता है।
कुछ विशेष उदाहरण
इस तरह से pH पैमाना हायड्रोजन आयन की सान्द्रता का उपयोग अम्ल और क्षार, दोनों की शक्ति और/या सान्द्रता दर्शाने के लिए करता है। लेकिन अब तक हमने सिर्फ उन पदार्थों पर विचार किया है जो जलीय विलयन में वियोजित होकर H+ या OH- आयन उत्पन्न करते हैं। फिर कॉपर सल्फेट या सोडियम कार्बोनेट जैसे पदार्थों का क्या किया जाए? ये क्यों क्रमश: अम्लीय और क्षारीय होते हैं?
सोडियम कार्बोनेट को लीजिए। यह एक अम्ल (कार्बोनिक अम्ल - H2CO3) और एक क्षार (सोडियम हायड्रॉक्साइड) की अभिक्रिया से बना लवण है। यदि हम पानी में इन दो पदार्थों के वियोजन को देखें तो निम्नलिखित समीकरणें सामने आती हैं
NaOH ⇌ Na+ + OH-
H2CO3 ⇌ 2H+ + CO32-
पहला एक प्रबल क्षार है और उसकी साम्यावस्था काफी दाईं ओर होती है। घोल में हमें अधिकांश सोडियम हायड्रॉक्साइड वियोजित अवस्था में मिलता है। लेकिन कार्बोनिक अम्ल एक दुर्बल अम्ल है जिसके वियोजन की साम्यावस्था काफी बाईं ओर होती है और अधिकांश कार्बोनिक अम्ल अवियोजित अवस्था में रहता है। इसका कारण यह है कि कार्बोनेट आयन को पानी के अणु बहुत ज़्यादा स्थिरता प्रदान नहीं करते। इनके हायड्रेशन से बहुत अधिक ऊर्जा मुक्त नहीं होती।
जब सोडियम कार्बोनेट को पानी में घोला जाता है तो उसका वियोजन निम्नानुसार होता है-
Na2CO3 ⇌ 2Na+ + CO32-
सोडियम आयनों का तो काफी अच्छी तरह हायड्रेशन हो जाता है और वे खुशी-खुशी विलयन में बने रहते हैं। लेकिन कार्बोनेट के साथ ऐसा नहीं होता। जब सोडियम आयनों का हायड्रेशन हो जाता है और वे अनुपलब्ध हो जाते हैं, तो कार्बोनेट आयन पानी के वियोजन से उत्पन्न हायड्रोजन आयनों से जुड़ जाते हैं और कार्बोनिक अम्ल बना लेते हैं। यहाँ स्थिति यह है कि पानी के अणुओं ने वियोजित होकर बराबर मात्रा में H+ और OH- आयन बनाए थे लेकिन H+ आयन का अपहरण एक तीसरे पक्ष ने कर लिया। इस वजह से घोल में अतिरिक्त OH- आयन बच गए और इस वजह से घोल क्षारीय है। pH सान्द्रता पर ज़रूर निर्भर करेगी लेकिन यह घोल दुर्बल क्षार होगा क्योंकि हायड्रॉक्साइड आयन तो मात्र पानी के वियोजन से मिल रहे हैं। इस मामले में पानी के आयन गुणनफल को 10-14 पर स्थिर रखने के लिए पानी के वियोजन की साम्यावस्था दाईं ओर सरक जाती है और शुद्ध पानी की अपेक्षा पानी के ज़्यादा अणु वियोजित होते हैं।
देखिए, क्या आप कॉपर सल्फेट के मामले में बता पाते हैं कि क्यों यह लवण अम्लीय घोल देता है। कॉपर सल्फेट दरअसल गन्धक का अम्ल (एक प्रबल अम्ल) और कॉपर हायड्रॉक्साइड (एक दुर्बल क्षार Cu(OH)2) से बना लवण है।
बफर घोल और जैविक तंत्र
मैं उम्मीद करती हूँ कि मैं pH, आयनीकरण से सम्बन्धित कुछ मुद्दों को स्पष्ट कर पाई हूँ और यह बता पाई हूँ कि इनका प्रबल/दुर्बल अम्ल और क्षार से क्या सम्बन्ध है। यदि आप अब तक मेरे साथ हैं, तो मैं बफर घोल का रोचक विषय उठाना चाहूँगी। बफर घोल मूलत: एक ऐसा घोल होता है जिसकी pH थोड़ा-बहुत अम्ल या क्षार मिलाने पर नहीं बदलती (हाँ, यदि बहुत अधिक अम्ल या क्षार डाला जाए तो बदलेगी)। बफर घोल जैविक तंत्रों (कोशिका के अन्दर और शरीर के द्रवों) में बहुत महत्वपूर्ण होते हैं क्योंकि जैविक तंत्रों में चलने वाली रासायनिक क्रियाओं का उत्प्रेरण एंज़ाइमों द्वारा किया जाता है जो प्रोटीन होते हैं। ये बहुत ही विशिष्ट pH पर सक्रिय रह पाते हैं और प्रबल अम्ल या क्षार इन्हें अक्रिय बना देते हैं।
हालाँकि, शारीरिक द्रवों में कई सारे विलेय घुले होते हैं लेकिन एक आसान-सा बफर पानी में एक दुर्बल अम्ल और उसके संयुग्मी (कॉन्जुगेट) क्षार को मिलाकर तैयार किया जा सकता है। तो यहाँ नए शब्द प्रकट हो गए हैं – संयुग्मी अम्ल या क्षार। तो ये क्या होते हैं?
याद करें कि कोई भी अम्ल वियोजित होकर दो आयन देता है – एक प्रोटॉन और एक ऋणायन (ऋणायन अम्ल-विशेष पर निर्भर करता है):
HA → H+ + A-
दुर्बल अम्ल के मामले में यह अभिक्रिया उत्क्रमणीय होती है:
HA ⇌ H+ + A-
चूँकि A- एक प्रोटॉन को खींच सकता है, इसलिए यह एक ब्रॉन्स्टेड क्षार है और कहा जाता है कि यह अम्ल HA का संयुग्मी क्षार है।
इसी प्रकार से एक दुर्बल क्षार के मामले में अभिक्रिया को निम्नानुसार लिखा जा सकता है:
BOH ⇌ B+ + OH-
B+ फिर OH- से क्रिया करके BOH बना सकता है और इसलिए इसे BOH का संयुग्मी अम्ल कहते हैं।
ठोस उदाहरण लेते हैं। CH3COO- दुर्बल अम्ल एसिटिक अम्ल (CH3COOH) का संयुग्मी क्षार है। और Cu2+ दुर्बल क्षार कॉपर हायड्रॉक्साइड (Cu(OH)2) का संयुग्मी अम्ल है।
तो दुर्बल अम्ल और उसके संयुग्मी क्षार के साथ बफर घोल बनाने के लिए, हम एसिटिक अम्ल लेते हैं और इसका संयुग्मी क्षार प्राप्त करने के लिए सोडियम एसिटेट डाल सकते हैं (जो पानी में घुलकर एसिटेट आयन देगा)।
सवाल यह है कि एक दुर्बल अम्ल और उसके संयुग्मी क्षार (या एक दुर्बल क्षार और उसके संयुग्मी अम्ल) को मिलाकर बनाया गया विलयन थोड़ा-सा अम्ल या क्षार डाले जाने पर pH को बदलने से कैसे रोकता है? याद करें कि बफर घोल की pH सिर्फ उस स्थिति में नहीं बदलती जब हम थोड़ी मात्रा में अम्ल या क्षार मिलाते हैं, ज़्यादा मात्रा में मिलाएँगे तो निश्चित रूप से बदलेगी।
यह देखते हैं कि हमारे रक्त की pH को एक दुर्बल अम्ल – कार्बोनिक अम्ल, H2CO3 – और उसके संयुग्मी क्षार – बायकार्बोनेट आयन, HCO3- - मिलकर कैसे स्थिर रखते हैं। यदि इसमें अम्ल डाला जाए तो बायकार्बोनेट आयन उससे क्रिया करके कार्बोनिक अम्ल बना देता है, जो एक दुर्बल अम्ल है और पूरी तरह वियोजित नहीं होता। इस प्रकार से घोल में से हायड्रोजन आयन हटा दिए जाते हैं। यदि इस घोल में क्षार डाला जाए तो कार्बोनिक अम्ल उससे क्रिया करके OH- आयनों को घोल में से हटा देता है। हम देख चुके हैं कि दुर्बल अम्ल घोल में पूरी तरह आयनीकृत नहीं होते और कैसे समीकरण HA ⇌ H+ + A- की साम्यावस्था बाईं ओर सरक जाती है। इस उत्क्रमणीय अभिक्रिया की साम्यावस्था को दाएँ-बाएँ सरकाना ही बफर घोल द्वारा pH को संरक्षित करने में मददगार होता है। रक्त के मामले में कार्बन डाईऑक्साइड (जो कार्बोनिक अम्ल के विघटन से बनती है) को फेफड़ों से हटाना भी pH को स्थिर रखने में मददगार होता है।
अब तक जो समझ विकसित हुई है, वह लुई अम्ल या क्षार की अवधारणा कैसे आगे बढ़ाती है? और यह अवधारणा अम्ल-क्षार अभिक्रियाओं के विचार को कैसे विस्तार देती है? शुरू में एक संक्षिप्त-सी परिभाषा देने के अलावा इस लेख में हमने लुई अम्ल व क्षार की बात को ज़्यादा आगे नहीं बढ़ाया है। लेकिन अब तक चर्चा जितनी विस्तृत रही है, उसे देखते हुए मैं लुई अम्ल-क्षार की चर्चा को किसी अगले लेख के लिए छोड़ रही हूँ। यदि आप में से कोई पाठक बात को आगे बढ़ाने के इच्छुक हों, तो फिर बात करेंगे।
उमा सुधीर: एकलव्य के साथ जुड़ी हैं। विज्ञान शिक्षण के क्षेत्र में काम कर रही हैं।
अँग्रेज़ी से अनुवाद: सुशील जोशी: एकलव्य द्वारा संचालित स्रोत फीचर सेवा से जुड़े हैं। विज्ञान शिक्षण व लेखन में गहरी रुचि।

