सुशील जोशी
रासायन शास्त्र में कार्बन के यौगिकों का अध्ययन एक अलग ही शाखा के अन्तर्गत किया जाता है। इसे अँग्रेज़ी में ऑर्गेनिक केमिस्ट्री और हिन्दी में कार्बनिक रसायन कहते हैं। अँग्रेज़ी और हिन्दी, दोनों भाषाओं में इसका नाम सकारण बता रहा हूँ। उस पहेली में जाने से पहले यह समझ लें कि कार्बनिक पदार्थ किन्हें कहते हैं। यूँ तो कार्बन के सारे यौगिकों को कार्बनिक यौगिक कह सकते हैं मगर सभी जानते हैं कि कार्बन डाईऑक्साइड, कार्बोनेट लवण वगैरह का अध्ययन हम अकार्बनिक रसायन में ही करते हैं हालाँकि ये कार्बन के यौगिक हैं। कोई स्पष्ट परिभाषा तो नहीं है मगर ऐसा प्रतीत होता है कि कार्बन के वे यौगिक ‘कार्बनिक’ के दायरे में माने जाते हैं जिनमें कार्बन के अलावा हाइड्रोजन भी हो।
इस प्रारम्भिक चर्चा के बाद फिर उसी बिन्दु पर लौटें कि मैंने अँग्रेज़ी व हिन्दी दोनों भाषाओं के नाम क्यों बताए थे। ऑर्गेनिक का मतलब होता है जैविक या जीवों से सम्बन्धित। एक समय पर ढेर सारे ऐसे पदार्थ थे जो हमें सिर्फ जैविक स्रोतों से प्राप्त होते थे -- शर्कराएँ, रंजक, कई तरह की औषधियाँ, गोंद वगैरह। ऐसा माना जाता था कि ये सजीवों में ही बन सकते हैं क्योंकि इन्हें बनाने के लिए जीवनी शक्ति (vital force) की ज़रूरत होती है। इसलिए रसायन शास्त्र की इस शाखा का नाम हुआ ऑर्गेनिक केमिस्ट्री (सजीव या जैविक रसायन शास्त्र)।
मगर जब विज्ञान की हर शाखा में उथल-पुथल शु डिग्री हुई तो यह शाखा भी अछूती नहीं रही। 1828 में फ्रेडरिक वोह्लर ने अमोनियम सायनेट को तपाया तो उन्हें जो पदार्थ मिला, वह विश्लेषण करने पर यूरिया निकला। सब लोग सहमत थे कि यूरिया एक ऑर्गेनिक पदार्थ है और अमोनियम सायनेट इनऑर्गेनिक। अब यदि अमोनियम सायनेट जैसे इनऑर्गेनिक पदार्थ को परखनली में लेकर तपाने भर से एक ऑर्गेनिक पदार्थ यानी यूरिया बन सकता है, तो ज़ाहिर है कि जीवनी शक्ति की तो वाट लग गई (यदि ‘वाट लगना’ शब्द असंसदीय हो, तो कह सकते हैं - जीवनी शक्ति का तो जनाज़ा निकल गया)। हालाँकि खुद वोह्लर ने यह निष्कर्ष नहीं निकाला था मगर सभी मानते हैं कि जीवनी शक्ति को अलविदा कहना इसी प्रयोग के साथ शु डिग्री हुआ था।
बहरहाल, रसायन शास्त्र के इस मोड़ के बाद भी लोग उसे ऑर्गेनिक केमिस्ट्री कहते रहे, और कोई बुराई भी नहीं है बशर्ते कि आप नामों का घालमेल अवधारणा की समझ के साथ न करें।
एक बार जब कार्बनिक पदार्थों का संश्लेषण शु डिग्री हुआ तो बात बढ़ती ही गई। इधर कार्बनिक पदार्थ बनाए जा रहे थे और उधर परमाणु सिद्धान्त भी आगे बढ़ रहा था। दोनों का तालमेल बनाना थोड़ा मुश्किल था और इस मुश्किल में से नई राहें निकली थीं।
आज हम 10 लाख से ज़्यादा कार्बनिक रसायन जानते-पहचानते हैं। शेष सारे, करीब 100 तत्वों को एक साथ रख दें, तो वे सब मिलकर भी इतने यौगिक नहीं बनाते। एक अनुमान के मुताबिक लगभग 95 प्रतिशत ज्ञात यौगिक कार्बनिक हैं। शायद यही कारण है कि विद्यार्थी कार्बनिक रसायन शास्त्र से बहुत घबराते हैं। मगर यहाँ चिन्ता का विषय वह नहीं है। चिन्ता या विचार का विषय तो यह है कि कार्बन में ऐसी क्या बात है कि वह इतने ज़्यादा यौगिक बना लेता है।
कार्बन की लड़ियाँ
कार्बन के यौगिकों में आमतौर पर कार्बन की लड़ियों या का एक ढाँचा होता है। कार्बन की ये दो कार्बन से लेकर हज़ारों कार्बन तक लम्बी हो सकती हैं। दूसरे शब्दों में कार्बन के परमाणु आपस में जुड़-जुड़कर एक ढाँचा बना लेते हैं। वैसे ऐसा नहीं है कि अन्य तत्वों में यह गुण शून्य है। कई तत्वों के परमाणु स्वतंत्र अवस्था में नहीं पाए जाते, वे जुड़कर अणु बना लेते हैं। जैसे हाइड्रोजन, ऑक्सीजन, हैलोजन्स, नाइट्रोजन वगैरह। इनमें से ऑक्सीजन तो तीन परमाणुओं वाला ओज़ोन अणु भी बनाता है। तत्वों के परमाणुओं का इस तरह आपस में जुड़ना केटिनेशन कहलाता है। लगता है कि कार्बन को यह गुण थोड़ा असामान्य मात्रा में मिला है।
|
तत्व आपस में जुड़ते क्यों हैं? |
इस सन्दर्भ में यह देखना उपयोगी होगा कि आवर्त तालिका में कार्बन समूह के अन्य तत्वों की क्या स्थिति है। आवर्त तालिका में कार्बन समूह 4-ए का पहला सदस्य है। इसी समूह में अन्य तत्व सिलिकॉन, जर्मेनियम, टिन व लेड हैं। सिलिकॉन करीब 14 परमाणुओं की बनाता है जबकि जर्मेनियम 9 परमाणुओं तक की बना पाता है। टिन और लेड, दोनों धातुएँ हैं और उनमें यह गुण नहीं पाया जाता। समूह 4-ए के तत्वों की बाह्य कक्षा में 4 इलेक्ट्रॉन पाए जाते हैं -- 2S22P2। मगर किसी वजह से कार्बन लम्बी-लम्बी बना लेता है वहीं ये तत्व ऐसा नहीं कर पाते। व्यावहारिक रूप में देखें तो कार्बन की कोई सीमा नहीं है। तो एक तरह से कार्बन इस मायने में अनूठा है। कार्बन के लगभग असंख्य यौगिकों के मूल में कार्बन की यही क्षमता है। आइए देखें कि ऐसा क्यों है।
|
कार्बनिक यौगिक और परमाणु सिद्धान्त |
बन्धनों की मज़बूती
जब भी दो परमाणु पास-पास आते हैं तो उनमें कई तरह से अन्तर्क्रिया हो सकती है। पहली है कि वे पास-पास आएँ और फिर दूर-दूर चले जाएँ। यानी ‘यूँ मिले थे कि मुलाकात हो न सकी’। दूसरा, यह भी हो सकता है कि वे पास-पास आएँ और उनके बीच कुछ ऐसा आकर्षण पैदा हो कि वे फिर से दूर-दूर न जाएँ। तब हम कहते हैं कि उनके बीच बन्धन बन गया है। अब इस बन्धन को तोड़ पाना इस बात पर निर्भर है कि यह बन्धन कितना मज़बूत बना है।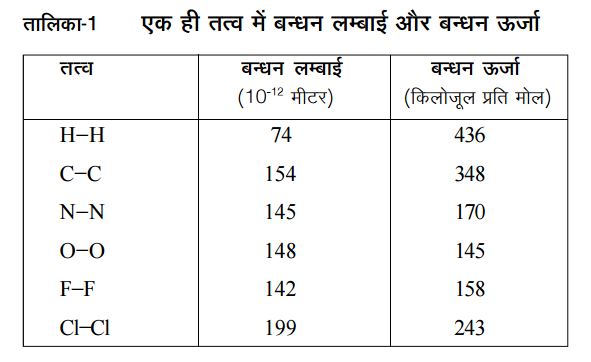
जैसे उन बन्धनों को देखें जो एक ही तत्व के दो परमाणुओं के बीच बनते हैं। तालिका-1 में कुछ तत्वों के बारे में जानकारी दी गई है। तालिका में उस बन्धन की लम्बाई भी दी गई है। बन्धन की लम्बाई से तात्पर्य यह है कि जब वह बन्धन बनता है तो दो परमाणु औसतन कितनी दूरी पर होते हैं। आमतौर पर देखा गया है कि बन्धन लम्बाई जितनी अधिक होगी बन्धन ऊर्जा उतनी कम होगी।
तालिका-1 से एक बात साफ उभरती है -- यदि हाइड्रोजन-हाइड्रोजन बन्धन को छोड़ दें तो एक ही तत्व के दो परमाणुओं के बीच सबसे मज़बूत बन्धन कार्बन ही बनाता है। अर्थात् कार्बन-कार्बन बन्धन प्रकृति का मज़बूत बन्धन नम्बर 2 है।
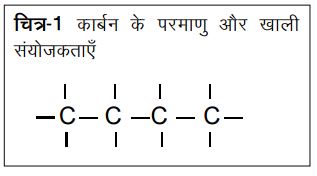
यह भी देखा जा सकता है कि दो अलग-अलग तत्वों के बन्धनों के सन्दर्भ में कार्बन कहाँ बैठता है। यह जानकारी तालिका-2 में दी गई है। एक बार फिर H-Fव H-C1 बन्धन के बाद सबसे मज़बूत बन्धन H-C ही है। लेकिन क्लोरीन व फ्लोरीन की दिक्कत यह है कि ये चाहे जितना मज़बूत बन्धन बना लें, एक ही बन्धन बना सकते हैं; इनकी संयोजकता 1 ही है। कार्बन की संयोजकता 4 है। लिहाज़ा कार्बन अन्य चार परमाणुओं से बन्धन बना सकता है।
वैसे कार्बन के बाह्य कक्षकों का सम्मिश्रण थोड़े अलग ढंग से भी हो सकता है और SP2 और SP कक्षक भी बन सकते हैं। इन कक्षकों से बने बन्धन SP3 की अपेक्षा कमज़ोर होते हैं। मगर यदि दो कार्बन परमाणुओं के बीच दो बन्धन हों, तो ज़ाहिर है अकेले बन्धन से ज़्यादा मज़बूत होंगे।
तो हमने देखा कि कार्बन-कार्बन बन्धन काफी मज़बूत बन्धन है और कार्बन आपस में एकल बन्धन भी बना सकते हैं और दोहरे व तिहरे बन्धन भी बना सकते हैं। हालाँकि दूसरे व तीसरे बन्धन प्रथम की अपेक्षा दुर्बल होते हैं मगर कुल मिलाकर अकेले बन्धन की तुलना में ज़्यादा शक्तिशाली होते हैं। तालिका-3 में विभिन्न तत्वों के ऐसे बन्धनों की तुलना की गई है।
देखें तो नाइट्रोजन-नाइट्रोजन तिहरा बन्धन कार्बन-कार्बन तिहरे बन्धन से ज़्यादा मज़बूत है मगर नाइट्रोजन-नाइट्रोजन तिहरा बन्धन बनने के बाद आगे बढ़ने की सम्भावना समाप्त हो जाती है क्योंकि नाइट्रोजन की संयोजकता 3 ही है।
|
बन्धन ऊर्जा क्या है? किसी बन्धन को बनाने से उत्सर्जित ऊर्जा या उस बन्धन को तोड़ने में खर्च होने वाली ऊर्जा को उस बन्धन की ऊर्जा कहते हैं। इसे ऊष्मा की इकाई किलोकैलोरी या किलोजूल प्रति मोल के रूप में व्यक्त किया जाता है। अलग-अलग यौगिकों में उन्हीं तत्वों के बीच बन्धन ऊर्जा अलग-अलग हो सकती है। इसलिए किन्हीं दो तत्वों के बीच बन्धन ऊर्जा उन तत्वों द्वारा विभिन्न स्थितियों में बनाए गए बन्धनों का एक औसत मान होती है। |
चूँकि कार्बन चार बन्धन बनाता है इसलिए तमाम सम्भावनाएँ उभरती हैं। एक तो जैसा कि ऊपर कहा गया कार्बन लम्बी-लम्बी बना सकता है। यह तो तब भी हो सकता था यदि कार्बन की संयोजकता 2 होती। मगर तब जो बनतीं वे शुद्ध कार्बन होतीं। मगर जब 4 बन्धन बन सकते हैं तो कार्बन सिर्फ लम्बाई में नहीं चौड़ाई में भी बढ़ सकती है और इस पर अन्य तत्वों के परमाणु भी जुड़ सकते हैं। जैसे यदि 4 कार्बन की एक को देखें तो यह दो तरह से बन सकती है।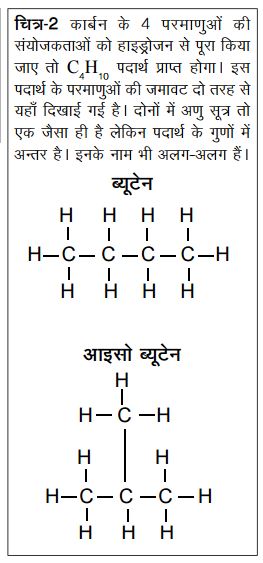
इसी गुण के कारण कार्बन के यौगिकों में एक और अनोखी बात सामने आती है। चूँकि कार्बन शाखित हो सकती हैं, इसलिए तत्वों के एक ही अनुपात या एक ही अणु सूत्र के साथ एक से अधिक संरचनाएँ बन सकती हैं (और बनती हैं)। जैसे ऊपर हमने 4 कार्बन का उदाहरण देखा। यदि इसमें कार्बन की शेष बची समस्त संयोजकताओं की पूर्ति हाइड्रोजन से की जाए तो हमें जो पदार्थ प्राप्त होगा, उसका अणु सूत्र होगा C4H10 मगर इस पदार्थ के परमाणु दो तरह से व्यवस्थित हो सकते हैं। (चित्र-2)
इस तरह से हमें 2 अलग-अलग पदार्थ मिलेंगे जिनके कुछ गुण तो एक से होंगे मगर कुछ गुणों में भिन्नता होगी। इन दो पदार्थों को ब्यूटेन व आइसोब्यूटेन कहते हैं। जब एक ही अणु सूत्र एक से अधिक आणविक संरचनाओं को दर्शाता है तो इसे आइसोमरिज़्म कहते हैं और ऐसी संरचनाएँ एक-दूसरे की आइसोमर कहलाती हैं। ज़ाहिर है कि कार्बन में कार्बन परमाणुओं की संख्या बढ़ते जाने के साथ-साथ सम्भावित संरचनाओं की संख्या भी बढ़ती जाएगी। उदाहरण के लिए यदि 10 कार्बन से बने हाइड्रोकार्बन (C10H22) को देखें तो इसके 75 अलग-अलग आइसोमर सम्भव हैं। आप चाहें तो इन्हें बनाकर देखें। और अभी तो हमने सिर्फ दो तत्वों (कार्बन व हाइड्रोजन) से बने यौगिकों की बात की है। यदि इनमें किसी तीसरे तत्व का समावेश किया जाए तो आइसोमरों की संख्या बहुत अधिक बढ़ जाएगी।
सुशील जोशी: एकलव्य द्वारा संचालित स्रोत फीचर सेवा से जुड़े हैं। विज्ञान लेखन में रुचि।