सुशील जोशी
कुछ चीज़ें पानी में घुल जाती हैं, कुछ नहीं घुलतीं। कुछ चीज़ें पानी में ज़्यादा घुलती हैं, कुछ कम घुलती हैं। ऐसा क्यों होता है? और जैसे इतना ही काफी नहीं था, कुछ चीज़ें घुलने पर घोल का आयतन कम हो जाता है, कुछ चीज़ों में पहले कम होता है मगर थोड़ा और पदार्थ घोलने पर बढ़ने लगता है। चक्कर क्या है?
दरअसल, ये सवाल आमोद कारखानिस ने पूछे हैं। और आमोद ने भी ये सवाल बच्चों के साथ किए गए कुछ प्रयोगों के आधार पर पूछे हैं। प्रयोग यह था कि वे शक्कर और नमक को पानी में अलग-अलग घोल रहे थे। एक तो उन्होंने देखा कि नमक की घुलनशीलता कम है जबकि शक्कर की बहुत ज़्यादा है। बच्चों का सवाल था कि ऐसा क्यों है?
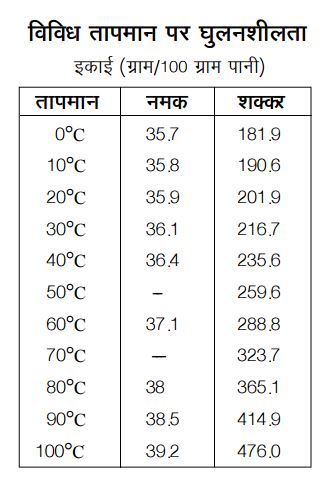
सबसे पहले यह देख लें कि नमक व शक्कर की घुलनशीलता में कितना अन्तर है। निम्नलिखित तालिका में विभिन्न तापमान पर दोनों पदार्थों की घुलनशीलता दी गई है।
तालिका से स्पष्ट है कि शक्कर की घुलनशीलता कहीं ज़्यादा है। इसके अलावा, तालिका से यह भी दिखता है कि इन दो पदार्थों की घुलनशीलता में एक अन्तर यह भी है कि जहाँ नमक की घुलनशीलता तापमान बढ़ने पर भी कमोबेश स्थिर रहती है, वहीं शक्कर की घुलनशीलता बढ़ती जाती है।
दूसरा, उन्होंने देखा कि पानी में शक्कर को घोलें तो शुरुआत में तो आयतन नहीं बढ़ता मगर एक हद से ज़्यादा शकर घोलें तो आयतन बढ़ने लगता है। दूसरी ओर नमक के साथ यह स्थिति नहीं आती। नमक जब तक घुलता है तब तक आयतन लगभग स्थिर रहता है और उसके बाद नमक घुलना ही बन्द हो जाता है। तो सवाल था कि शक्कर घोलने से पानी का आयतन क्यों बढ़ जाता है जबकि, नमक घोलने पर ऐसा नहीं होता।
पता नहीं मैं इन सवालों के जवाब दे पाऊँगा या नहीं मगर इतना बताने का वायदा करता हूँ कि घुलनशीलता एक दिलचस्प और पेचीदा चीज़ है।
कोई पदार्थ कितना घुला है इसे दर्शाने के लिए कई तरीके इस्तेमाल किए जाते हैं। ये अलग-अलग तरीके ही स्पष्ट कर देते हैं कि घुलनशीलता के विवरण में कठिनाइयाँ हैं। जैसे एक तरीका है कि कितने विलायक में कितना विलेय घुला। यहाँ ‘कितना’ को आप आयतन के रूप में दर्शाएँगे या वज़न के रूप में? आयतन के रूप में दर्शाएँगे तो मुश्किल होगी। मान लीजिए, आपने 10 ग्राम शक्कर को 100 मि.ली. पानी में घोला। जो घोल बना वह तो 100 मि.ली. नहीं है। तो यदि आप कहते हैं कि इस तरह बने घोल में 10 ग्राम शक्कर प्रति 100 मि.ली. है तो आपको लिखना होगा कि इसका मतलब है 10 ग्राम शक्कर प्रति 100 मि.ली. पानी। दूसरा तरीका यह हो सकता है कि आप इस बात को इस तरह लिखें: 10 ग्राम शक्कर प्रति ‘न्’ मि.ली. घोल। यहाँ ‘न्’ मि.ली. से मतलब अन्तत: बने घोल के आयतन से होगा। फिर एक तरीका यह है कि आप विलायक तथा विलेय दोनों वज़न में बताएँ। आप चाहें तो यह बता सकते हैं कि किसी घोल के एक निश्चित आयतन में विलेय के कितने मोल हैं। यानी घोल के बारे में बात करने के कई तरीके हैं (बॉक्स - घुलनशीलता दर्शाने के विभिन्न तरीके)।
जब आप किसी विलेय को विलायक के निश्चित आयतन में घोलेंगे तो पाएँगे कि एक निश्चित तापमान पर वह एक हद तक घुलता है। अर्थात् प्रत्येक विलेय और विलायक जोड़ी के लिए किसी भी तापमान पर घुलन- शीलता निश्चित होती है। तापमान बदलने पर घुलनशीलता बदल जाती है - जैसा कि ऊपर दिए गए आँकड़ों में दिखता है; किसी मामले में कम बदलती है तो किसी में ज़्यादा। विलायक की एक निश्चित मात्रा में अधिकतम जितना विलेय घुल सकता है वह उसकी घुलनशीलता कहलाती है। घुलनशीलता तापमान पर निर्भर है इसलिए घुलन- शीलता के साथ तापमान बताना आवश्यक है। आम तौर पर ठोस पदार्थों की घुलनशीलता तापमान बढ़ने के साथ बढ़ती है (इसके कुछ अपवाद भी हैं)। यहाँ यह कहना लाज़मी है कि सभी गैसों की घुलनशीलता तापमान के साथ घटती है। बहरहाल, यहाँ हम तरल विलायक और ठोस विलेयों की बात ही करेंगे।
पदार्थ घुलते क्यों हैं?
पदार्थ का किसी भी विलायक में घुलना कई प्रक्रियाओं का मिला-जुला परिणाम होता है। फिलहाल, हम ठोस विलेयों की बात करेंगे और विलायक के रूप में पानी की। ठोस पदार्थों के अणुओं के बीच कम या ज़्यादा परस्पर आकर्षक बल लगते हैं। इस प्रकार से विलायक के अणुओं के बीच भी आकर्षक बल काम करते हैं। अभी इन आकर्षक बलों की प्रकृति में न जाएँ, बस इतना मानें कि अणुओं के बीच ऐसे आकर्षण बल होते हैं। किसी पदार्थ के घुलने के लिए उसके अपने अणुओं के बीच आकर्षण बलों से और विलायक के अणुओं के बीच के आकर्षण बलों से पार पाना होता है। इस काम में ऊर्जा खर्च होती है। दूसरी ओर विलायक और विलेय के अणुओं के बीच आकर्षण बल पैदा होते हैं। इस क्रिया में ऊर्जा निकलती है। यानी घुलने के दौरान मोटे तौर पर देखें तो कुछ बन्धन (दुर्बल या प्रबल) तोड़े जाते हैं और कुछ नए बन्धन बनाए जाते हैं। इस सारे बनने-बिगड़ने का परिणाम होता है कि पूरा तंत्र एक नई ऊर्जा अवस्था में पहुँचता है। घुलनशीलता इस बात पर निर्भर करती है कि इस प्रक्रिया में कुल ऊर्जा बढ़ती है या घटती है। दूसरे शब्दों में क्या विलेय के घुलने से पूरा तंत्र ज़्यादा स्थिरता प्राप्त करता है या और ज़्यादा अस्थिर हो जाता है।
कहा जाता है कि समान पदार्थ आपस में घुलते हैं, असमान पदार्थ नहीं घुलते। यहाँ समान-असमान से तात्पर्य पदार्थों की आणविक संरचना से है। मोटे तौर पर देखें तो पदार्थ दो प्रकार के होते हैं। एक किस्म के पदार्थों में विद्युत संयोजी बन्धन पाए जाते हैं जबकि दूसरे किस्म के पदार्थों में सह संयोजी (covalent)। दूसरी तरह से देखें तो कुछ पदार्थ ध्रुवीय (polar) होते हैं जबकि कुछ पदार्थ अध्रुवीय (non-polar) होते हैं। ध्रुवीय पदार्थ उन्हें कहते हैं जिनके अणु में विद्युत आवेश का वितरण असन्तुलित होता है। इनके अणु में कोई भाग ऋणावेशित होगा तो कोई भाग धनावेशित। इसके विपरीत, अध्रुवीय पदार्थों में कोई भी हिस्सा आवेश-युक्त नहीं होता क्योंकि आवेश पूरे अणु पर समान रूप से वितरित होता है।
पानी हालाँकि, सहसंयोजी पदार्थ है मगर हाइड्रोजन व ऑक्सीजन के विद्युतीय गुणधर्मों में अन्तर और पानी के अणु की बनावट के कारण हाइड्रोजन वाले छोर थोड़े-से धनावेशित होते हैं जबकि ऑक्सीजन वाला छोर थोड़ा-सा ऋणावेशित होता है। आवेशों के इस असन्तुलन के कारण पानी ध्रुवीय पदार्थ होता है। तो उम्मीद की जानी चाहिए कि ध्रुवीय पदार्थ पानी में घुलेंगे।
अब विलेयों पर विचार करते हैं। यह तो हमने देखा कि ठोस पदार्थ ध्रुवीय या अध्रुवीय हो सकते हैं। चूँकि पानी एक ध्रुवीय पदार्थ है इसलिए इसमें ध्रुवीय पदार्थ आसानी से घुलते हैं। मगर आमोद और उसके छात्रों की मेहरबानी से हमने देखा कि पानी के साथ शक्कर और नमक का व्यवहार काफी अलग-अलग है। इसलिए हमें ध्रुवीय पदार्थों की प्रकृति पर भी विचार करना होगा।
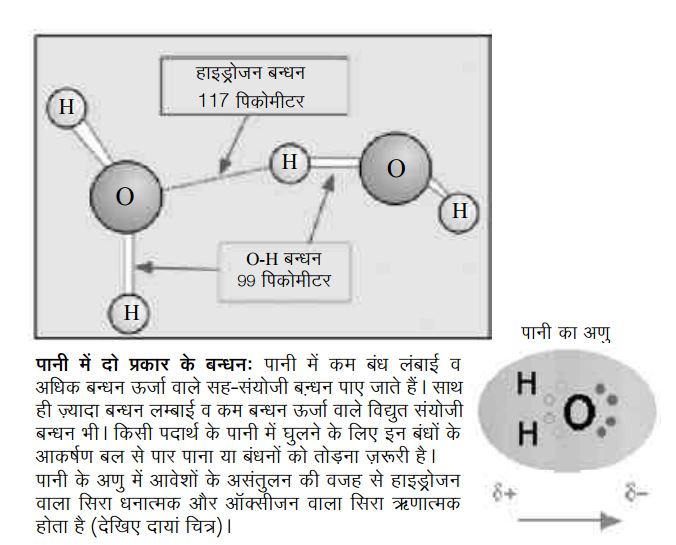
कोई भी अणु ध्रुवीय क्यों होता है? इसके मोटे तौर पर दो कारण हो सकते हैं। एक कारण तो वह है जिसके कारण पानी का अणु ध्रुवीय हो जाता है। पानी के अणु में आवेशों के असन्तुलन के कारण हाइड्रोजन वाले सिरे थोड़े धनात्मक और ऑक्सीजन वाला सिरा थोड़ा ऋणात्मक होता है। परिणाम स्वरूप पानी के एक अणु का हाइड्रोजन वाला सिरा किसी अन्य अणु के ऑक्सीजन वाले सिरे से आकर्षित हो सकता है (और होता भी है)। इस प्रकार से पानी में O-H, सह-संयोजी बन्धनों के अलावा कुछ दुर्बल किस्म के विद्युत आकर्षण बन्धन भी बन जाते हैं। इन्हें हाइड्रोजन बन्धन कहते हैं। इनकी वजह से पानी के अणु स्वतंत्र विचरने की बजाय एक-दूसरे से दुर्बल बन्धनों से बँधे रहते हैं। पानी में O-H बन्धन की ऊर्जा 458.9 किलोजूल प्रति मोल है जबकि हाइड्रोजन बन्धनों की औसत ऊर्जा करीब 23 किलोजूल प्रति मोल है। इसका मतलब है कि पानी के अणुओं के बीच एक मोल हाइड्रोजन बन्धनों को तोड़ने के लिए इतनी ऊर्जा खर्च होगी। पानी के अणुओं के बीच मौजूद ये हाइड्रोजन बन्धन पानी को कुछ विशिष्ट गुण प्रदान करते हैं। यहाँ गौरतलब बात यह है कि हाइड्रोजन बन्धन की ऊर्जा विभिन्न पदार्थों में 5 से 30 किलोजूल प्रति मोल तक हो सकती है।
शक्कर का अणु भी इसी प्रकार का अणु है। इसमें कार्बन, हाइड्रोजन और ऑक्सीज़न के परमाणु पाए जाते हैं (सूत्र C12 H22 O11) और ये सब आपस में सह-संयोजी बन्धनों से जुड़े होते हैं। सह-संयोजी बन्धन काफी मज़बूत बन्धन होते हैं। इन्हें आसानी से तोड़ा नहीं जा सकता। मगर शक्कर में एक और किस्म के बन्धन पाए जाते हैं। पूरे अणु में कुछ O-H समूह होते हैं। इनमें भी हाइड्रोजन वाला सिरा थोड़ा धनावेशित और ऑक्सीजन वाला सिरा थोड़ा ऋणावेशित होता है। लिहाज़ा, शक्कर के एक अणु के C-H समूह के क्त का किसी दूसरे अणु के ग्र् के साथ आकर्षण होता है और विभिन्न अणुओं के बीच हाइड्रोजन बन्धन बन जाते हैं। शक्कर को ठोस अवस्था में बनाए रखने में इन हाइड्रोजन बन्धनों की ही महत्वपूर्ण भूमिका है। शक्कर में हाइड्रोजन बन्धनों की औसत ऊर्जा 13 किलोजूल/प्रति मोल होती है।
आयनिक पदार्थ
दूसरे प्रकार के ध्रुवीय पदार्थ वे हैं जिनमें परमाणुओं के बीच बन्धन सह-संयोजी नहीं बल्कि विद्युत-संयोजी होते हैं। इनमें जब दो तत्वों के परमाणु आपस में जुड़ते हैं तो एक तत्व का परमाणु अपना एक या अधिक इलेक्ट्रॉन दूसरे तत्व के परमाणु को दान कर देता है। जिसने दान किया वह धनावेशित हो जाता है और जिसने पाया वह ऋणावेशित हो जाता है। अब ये परस्पर विपरीत आवेशित परमाणु (जिन्हें आयन कहते हैं) आवेशों के कारण आपस में चिपके रहते हैं। नमक इसी प्रकार का पदार्थ है। इसमें सोडियम (2,8,1) अपना एक इलेक्ट्रॉन क्लोरीन (2,8,7) को दान कर देता है। इस प्रकार से सोडियम धनायन (2,8) और क्लोराइड ऋणायन (2,8,8) बन जाते हैं। अणु बनता है इन आयनों के बीच आकर्षण के कारण। इसी को विद्युत संयोजी बन्धन कहते हैं।
ऐसे पदार्थों को आयनिक पदार्थ कहते हैं। ये वास्तव में, एक-एक अणु के रूप में नहीं पाए जाते बल्कि एक जालक (लैटिस) के रूप में पाए जाते हैं। इनमें प्रत्येक धनायन कई ऋणायनों से घिरा होता है और प्रत्येक ऋणायन कई धनायनों से घिरा होता है। पूरी व्यवस्था काफी सलीकेदार होती है और प्रत्येक आयनिक पदार्थ की लैटिस संरचना निर्धारित व निश्चित होती है। जैसे सोडियम क्लोराइड की जालक संरचना साथ के चित्र में देखी जा सकती है। सोडियम क्लोराइड की लैटिस ऊर्जा लगभग 750 किलोजूल प्रति मोल है। इसका मतलब है कि यदि एक मोल सोडियम व क्लोराइड आयन गैस अवस्था में हों, और उन्हें लैटिस रूप में जमाया जाए तो लगभग 750 किलोजूल ऊर्जा निकलेगी। दूसरे शब्दों में लैटिस व्यवस्था सोडियम क्लोराइड को काफी स्थिरता प्रदान करती है। इसका अर्थ यह भी है कि इस लैटिस को तोड़ने में काफी ऊर्जा लगानी होगी।
दूसरी ओर शक्कर के अणुओं के बीच जो अन्तर्क्रिया होती है उसके मूल में हाइड्रोजन बन्धन हैं जो काफी दुर्बल होते हैं। इन्हें तोड़ने में बहुत अधिक ऊर्जा खर्च नहीं होती।
घुलना मतलब...
मान लीजिए शक्कर पानी में घुल रही है। होगा यह कि शक्कर के अणुओं के बीच जो भी आकर्षण या बन्धन हैं उन्हें तोड़ा जाएगा। दूसरी ओर पानी के अणुओं के बीच जो भी बन्धन हैं उन्हें भी तोड़ा जाएगा। इसके बाद पानी और शक्कर के अणुओं के बीच नए सिरे से बन्धन बनेंगे। ऊपर हमने देखा कि शक्कर के अणु दुर्बल हाइड्रोजन बन्धनों से जुड़े होते हैं। इसी प्रकार से पानी के अणु भी आपस में हाइड्रोजन बन्धन से जुड़े होते हैं। मतलब शक्कर पानी में घुलेगी तो कुछ दुर्बल हाइड्रोजन बन्धन टूटेंगे और कुछ दुर्बल हाइड्रोजन बन्धन बनाने होंगे। कुल मिलाकर बहुत ज़्यादा ऊर्जा का जमा-खर्च नहीं है। इसलिए शक्कर पानी में आसानी से और ज़्यादा मात्रा में घुलती है।
अब ज़रा नमक को घोलने की कोशिश करें। जैसा कि हमने ऊपर देखा नमक यानी सोडियम क्लोराइड ठोस अवस्था में एक लैटिस के रूप में होता है। इस लैटिस में प्रत्येक आयन विपरीत आवेश वाले आयनों से घिरा होता है। लैटिस ऊर्जा 750 किलोजूल प्रति मोल होती है। सोडियम क्लोराइड का एक मोल यानी 58 ग्राम है। इसका मतलब यह हुआ कि 58 ग्राम सोडियम क्लोराइड क्रिस्टल को आयनों के रूप में विभक्त करने में 750 किलोजूल ऊर्जा लगेगी। जब नमक को पानी में डाला जाता है तो यह क्रिया होने लगती है। सोडियम व क्लोराइड आयन अलग-अलग होने लगते हैं। इसके साथ ही ये आयन पानी के अणुओं को आकर्षित करते हैं। सोडियम धनायन पानी के अणु के ऋणावेशित भाग (ऑक्सीजन वाला छोर) को आकर्षित करते हैं जबकि क्लोराइड ऋणायन पानी के अणु के धनावेशित भाग (हाइड्रोजन वाले छोर) को आकर्षित करते हैं। इस आकर्षण की वजह से आयनों के आस-पास पानी के अणुओं का एक आवरण-सा बन जाता है। इसे प्राथमिक आवरण कहते हैं। यह हिस्सा काफी सलीकेदार होता है। प्राथमिक आवरण के आस-पास के पानी के अणु हाइड्रोजन बन्धनों से जुड़े होते हैं और इस हिस्से में भी काफी ‘व्यवस्था’ पाई जाती है। इसके बाहर पानी का सैलाब होता है। यह व्यवस्था घोल को स्थिरता प्रदान करती है। आयनों के इस तरह पानी के अणुओं से घिरने की प्रक्रिया को हाइड्रेशन कहते हैं।
मगर यहाँ ध्यान देने की बात यह है कि सोडियम और क्लोराइड आयनों का लैटिस से टूटकर अलग होना और पानी के अणुओं से जुड़ना तथा इन आयनों का वापस आपस में जुड़ जाना, ये दोनों एक साथ चलने वाली क्रियाएँ हैं।
अर्थात् आयन टूट-टूटकर घोल में आते रहते हैं और साथ ही साथ आयन आपस में जुड़-जुड़कर घोल से बाहर भी निकलते रहते हैं। ऐसी क्रियाओं को उत्क्रमणीय क्रियाएँ (reversible reactions) कहते हैं। जैसे ही नमक को पानी में डाला जाता है दोनों क्रियाएँ शु डिग्री हो जाती हैं। नमक घुलता नज़र आता है क्योंकि आयन टूटने की क्रिया अपेक्षाकृत तेज़ गति से चलती है। धीरे-धीरे काफी सारे आयन पानी में पहुँच जाते हैं और इसके साथ ही आयनों के जुड़ने की क्रिया भी गति पकड़ने लगती है। कुछ समय बाद दोनों क्रियाएँ बराबर गति से चलने लगती हैं। यानी बाहर से देखने पर न तो और नमक घुलता नज़र आएगा, न अवक्षेपित होता। यह वह स्थिति है जब अधिकतम सम्भव नमक घुल चुका है।
सोडियम व क्लोराइड आयनों को लैटिस अवस्था से हाइड्रेट्ड अवस्था में लाने की ऊर्जा 19 किलोजूल/मोल है। मतलब जब एक मोल सोडियम क्लोराइड को ठोस लैटिस अवस्था से हाइड्रेट्ड अवस्था में लाया जाता है तो 19 किलोजूल ऊर्जा सोखी जाती है। सीधे-सादे शब्दों में, नमक को पानी में घोलने पर घोल थोड़ा ठण्डा हो जाएगा। एक बात ध्यान में रखने की है - लैटिस ऊर्जा का प्रायोगिक मापन नहीं किया जा सकता। इसकी गणना सैद्धान्तिक आधार पर की जाती है। अलग-अलग विधियों का उपयोग करने पर इसका मान अलग-अलग आता है। यदि थोड़े अलग ढंग से गणना करें तो सोडियम क्लोराइड की हाइड्रेशन ऊर्जा 3.88 किलोजूल/मोल निकलती है।
तो नमक पानी में कम घुलता है क्योंकि सोडियम क्लोराइड के रवे (लैटिस) में से आयनों को अलग करना एक ऊर्जा-खर्ची प्रक्रिया है। हाइड्रेशन की क्रिया इस ऊर्जा की भरपाई जिस हद तक कर सकती है, उसी हद तक नमक घुलता है। शक्कर के रवे मात्र हाइड्रोजन बन्धनों की बदौलत बनते हैं, इसलिए इन्हें तोड़कर पानी के साथ हाइड्रोजन बन्धन बनाना ऊर्जा की दृष्टि से उतनी प्रतिकूल क्रिया नहीं है। इसलिए शक्कर ज़्यादा मात्रा में घुल जाती है।
आयतन का चक्कर
आमोद और उसके छात्रों ने यह भी देखा था कि शक्कर घोलने पर कुछ समय के बाद आयतन बढ़ना शु डिग्री हो जाता है। अर्थात् यदि उन्होंने 100 मि.ली. पानी लिया था और उसमें (मान लें कि) 100 ग्राम शक्कर घोली तो घोल का आयतन 100 मि.ली. न रहकर 100 अ ‘न्’ मि.ली. हो गया। वैसे यह तो वे ही बता सकते हैं कि उन्हें यह उम्मीद क्यों थी कि आयतन नहीं बढ़ेगा। आखिर हम एक चीज़ में दूसरी चीज़ डाल रहे हैं तो आयतन तो बढ़ना चाहिए। आयतन न बढ़ने की उम्मीद तो तभी की जानी चाहिए जब पानी में खूब सारी खाली जगह हो जहाँ नमक या शक्कर फिट हो जाए।
वैसे पानी में नमक घोलने के अनुभव से तो लगता है कि पानी के अन्दर काफी जगह होती है क्योंकि नमक घोलने पर आयतन नहीं बढ़ा था और शक्कर घोलने पर भी कुछ समय तक तो आयतन नहीं ही बढ़ा था। कुछ तो चक्कर है। मगर उस चक्कर में पड़ने से पहले एक बात पर ध्यान देना मुनासिब होगा।
घोल में सोडियम आयन का प्रभावी अर्धव्यास औसतन 0.10 नैनोमीटर है और क्लोरीन का 0.18 नैनोेमीटर। मगर जलीय घोल में ये आयन कहीं अधिक जगह घेरते हैं - हाइड्रेट्ड सोडियम आयन 0.45 नैनोमीटर और हाइड्रेट्ड क्लोराइड आयन 0.3 नैनोमीटर। दूसरी ओर शक्कर के अणु का अर्धव्यास करीब 1 नैनोमीटर होता है। तुलना के लिए पानी के एक अणु का अर्धव्यास 0.28 नैनोमीटर है। इससे तो लगता है कि शक्कर और सोडियम व क्लोराइड आयन लगभग बराबर जगह घेरते हैं। यदि ये बराबर जगह घेरते हैं तो शक्कर व नमक घोलने पर आयतन में होने वाले परिवर्तन को देखते हुए यह भी लगता है कि ये पानी में जो जगह घेरते हैं उसके ढंग में ज़रूर कुछ अन्तर है।
आमोद व उनके छात्रों के विवरण से स्पष्ट नहीं होता कि शक्कर या नमक घोलने पर जिस आयतन परिवर्तन की बात हो रही है वह किस चीज़ का आयतन है। इसे इस तरह से देखिए। मान लीजिए हमने 100 ग्राम (उ 100 मि.ली.) पानी लिया है। इसमें हमने 20 ग्राम शक्कर घोली। घोल का आयतन कितना होना चाहिए? यदि आयतन आपस में जुड़ते, तो घोल का आयतन होगा 100 मि.ली. अ 20 ग्राम शकर का आयतन। आपको 20 ग्राम शकर का आयतन अलग से निकालना होगा। जैसे आप नपे हुए मिट्टी के तेल में शक्कर डालकर आयतन में वृद्धि देख सकते हैं। जब हम कहते हैं कि आयतन कम हुआ तो हमारा मतलब यह है कि घोल का वास्तविक आयतन पानी व शक्कर के कुल आयतन से कम है।
इस दृष्टि से देखें तो चाहे शक्कर लें या नमक, दोनों मामलों में घोल का आयतन एक सान्द्रता तक पानी और उस पदार्थ के आयतनों के योग से कम होता है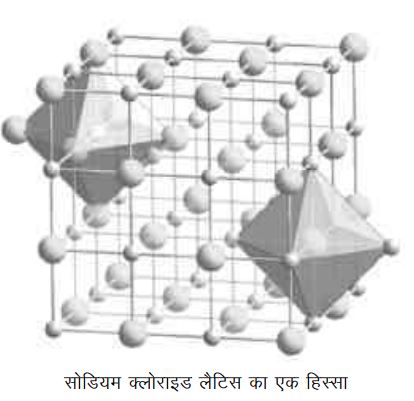
अभी तक हमने पानी की आणविक संरचना पर ही गौर किया है। इससे स्पष्ट है कि पानी के अणुओं के बीच हाइड्रोजन बन्धन होते हैं जिनकी वजह से ये अणु पूरी तरह एक-दूसरे से स्वतंत्र नहीं होते। यहाँ यह जानना रोचक होगा कि पानी की संरचना में इससे भी कहीं ज़्यादा गहराइयाँ हैं और इसी वजह से आज भी पानी रसायन व भौतिक शास्त्र में अध्ययन का एक महत्वपूर्ण विषय बना हुआ है। पिछले वर्षों में इस बात पर काफी बहस चली है कि हाइड्रोजन बन्धनों की वजह से पानी के अणु किस हद तक आपस में जुड़े हुए रहते हैं। कुछ लोगों का मानना है कि पानी में लगभग सारे अणुओं के बीच इस तरह के बन्धन बनते हैं और वे एक विशाल ताने-बाने में जुड़े रहते हैं। दूसरी ओर कुछ लोग मानते हैं कि पानी के अणुओं की छोटी-छोटी बनती हैं और बनती-बिगड़ती रहती हैं। ये कितनी बड़ी बनेंगी, यह तापमान पर निर्भर होता है।
ताज़ा अनुसन्धान ने इस सवाल पर काफी रोशनी डाली है। अनुसन्धान के नतीजे बताते हैं कि पानी के अणुओं के बीच हाइड्रोजन बन्धन इतनी तेज़ गति से बनते-बिगड़ते हैं कि लगभग पूरी जलराशि को आपस में जुड़ा हुआ माना जा सकता है। मगर इसमें बीच-बीच में कुछ अपेक्षाकृत स्थायी झुण्ड भी बनते हैं। ये छोटे-छोटे झुण्ड बनने पर इनके बीच काफी खाली जगह रहती है। पानी यदि 00 सेल्सियस पर है तो ऐसे एक-एक झुण्ड में पानी के 90 तक अणु हो सकते हैं। तापमान बढ़ने के साथ ये झुण्ड छोटे होते जाते हैं क्योंकि हाइड्रोजन बन्धन जल्दी टूटने लगते हैं। अध्ययनों से लगता है कि 70 डिग्री सेल्सियस पर ये झुण्ड औसतन 25 अणुओं के बने होते हैं। यह भी स्पष्ट हुआ है कि पानी के अणुओं के जुड़ने से जो सबसे स्थायी संरचना बनती है वह एक चतुष्फलक यानी टेट्राहेड्रॉन है।
बहरहाल, इतना तो स्पष्ट है कि अच्छे-खासे पानी से भरे गिलास में काफी खाली जगह रहती है। मुझे यह आँकड़ा नहीं मिल पाया है कि यह जगह पानी के कुल आयतन (यानी प्रेक्षित आयतन) की तुलना में कितनी होती है। जब खाली जगह मौजूद है तो विलायक वहाँ घुसकर बैठ सकता है और इसकी वजह से घोल का आयतन नहीं बढ़ेगा। मगर आमोद और उसके छात्रों का कहना है कि इस मामले में शक्कर और नमक अलग-अलग व्यवहार दर्शाते हैं।
दो पदार्थों के व्यवहार में अन्तर
शक्कर और नमक के घुलनशीलता सम्बन्धी व्यवहार में अन्तर का कारण यह लगता है कि वे पानी की इस संरचना के साथ अलग-अलग ढंग से अन्तर्क्रिया करते हैं। पहले शक्कर के घोल को देखते हैं।
जब शक्कर पानी में घुलती है तो उसके अणु पानी में मौजूद उपरोक्त खाली जगहों में समा जाते हैं। वहाँ ये अणु पानी के अणुओं के साथ हाइड्रोजन बन्धन बनाते हैं। इन बन्धनों का परिणाम यह होता है कि पानी की उपरोक्त संरचना को और स्थिरता मिलती है। साथ में दिए गए ग्राफ को देखने पर पता चलता है कि शक्कर घोलने पर घोल का घनत्व बढ़ने लगता है। इसका मतलब है कि शक्कर और पानी के अलग-अलग आयतन का योग घोल के आयतन से ज़्यादा है। मतलब वज़न तो जुड़ रहे हैं मगर आयतन कम हो रहा है। यह स्थिति करीब 5-7 मोल प्रतिशत घोल पर आती है। मतलब जब पानी के 100 मोल में 5-7 मोल तक शक्कर घोली जाती है, तब तक घोल का आयतन शक्कर व पानी के कुल आयतन से कम रहता है। 100 मोल पानी यानी करीब 1800 मि.ली. पानी और 5-7 मोल शक्कर मतलब करीब 1710-2400 ग्राम शक्कर। अर्थात् 100 मि.ली. पानी में 95-130 ग्राम शक्कर घोलने तक घोल का आयतन घटना चाहिए यानी कि वह आयतनों के योग के अनुपात में नहीं बढ़ता। इसके बाद आयतन में वृद्धि शुरु हो जानी चाहिए।
आमोद और उनके छात्रों के पास सम्भवत: इतने परिष्कृत उपकरण न होंगे कि वे इतना सब करके देख पाते मगर अन्य प्रयोगशालाओं में काफी सटीकता से किए गए प्रयोगों का यही अवलोकन है।
तो यह बात तो समझ में आई कि शक्कर घोलने पर आयतन कम इसलिए होता है कि शक्कर पानी की संरचना को और स्थिरता प्रदान कर देती है। शक्कर के अणु पानी के अणुओं को बाँधकर रखने का काम करते हैं। यह पूरी संरचना ज़्यादा सघन होती है।
इससे ज़्यादा शक्कर घोलने पर वह दौर आता है जब शक्कर के अणु इस व्यवस्था में समा नहीं पाते और इसे तोड़ने लगते हैं। जब यह टूटती है तो पानी के अणु बिखर जाते हैं और उनकी गतियाँ स्वतंत्र हो जाती हैं। अब सारी खाली जगहें न सिर्फ समाप्त हो चुकी हैं बल्कि शक्कर डालते जाने के कारण और भी कम होने लगी हैं। लिहाज़ा, आयतन बढ़ने लगता है। इस बात को साथ दिए चित्रों में देखने की कोशिश करें। शक्कर का मामला स्पष्ट हो गया है, तो नमक पर चलें।
नमक यानी सोडियम क्लोराइड एक आयनिक पदार्थ है जो पानी में घुलने पर आयनों में विभक्त होने लगता है। इसे जल अपघटन कहते हैं। इसके लिए पानी का उच्च डाइ-इलेक्ट्रिक स्थिरांक ज़िम्मेदार है। इस तरह से पानी में सोडियम क्लोराइड नहीं बल्कि सोडियम धनायन और क्लोराइड ऋणायन पाए जाते हैं। पानी के अणुओं के साथ इनका तीव्र आकर्षण होता है। आयन भी पानी के अन्दर मौजूद उन्हीं गुहाओं में फिट होते हैं मगर ये उस संरचना को एक नया ही आकार प्रदान करते हैं। प्रत्येक सोडियम और क्लोराइड आयन चारों ओर से पानी के अणुओं से घिर जाता है। सोडियम के धनायनों की ओर पानी के अणु के ऑक्सीजन वाले छोर आकर्षित होते हैं जबकि क्लोराइड ऋणायन हाइड्रोजन वाले सिरों को आकर्षित करता है। पानी के ये अणु अपने तईं पानी के अन्य अणुओं से हाइड्रोजन बन्धन बना लेते हैं। इस प्रकार से प्रत्येक सोडियम व क्लोराइड आयन अपने इर्द-गिर्द पानी के अणुओं का अच्छा खासा जमावड़ा बना लेता है। इस संरचना की वजह से पानी के अणुओं की जमावट काफी घनी हो जाती है।

उक्त विवरण से तो लगेगा कि सोडियम क्लोराइड नहीं घुलना चाहिए। अलबत्ता देखने वाली बात यह है कि सोडियम क्लोराइड लैटिस से हाइड्रेट्ड सोडियम व क्लोराइड आयन बनने में ऊर्जा अवशोषण बहुत कम (करीब 19 किलोजूल प्रति मोल) ही होता है। दूसरी ओर, इस प्रक्रिया में लैटिस जैसी सलीकेदार व्यवस्था से पानी में बिखरे आयन जैसी बेतरतीब व्यवस्था बन रही है। अत: एंट्रॉपी बढ़ रही है जो इस क्रिया को सम्भव बनाती है।
मगर यहाँ हमें इस सम्भावना पर विचार करना होगा कि पानी की दी गई मात्रा में कितने आयनों को पूरी तरह हाइड्रेट किया जा सकता है। इस तरह के अध्ययन हुए तो ज़रूर हैं मगर इनके परिणामों तक मेरी पहुँच नहीं है। अलबत्ता, यदि हम यह मानें कि प्रत्येक सोडियम आयन या क्लोराइड आयन को हाइड्रेट करने में पानी के 8 अणु शामिल होते हैं, तो यह सोडियम क्लोराइड की अधिकतम घुलशीलता हो गई। आँकड़े भी यही दर्शाते हैं कि 8 मोल (करीब 150 ग्राम) पानी में करीब 1 मोल (58 ग्राम) सोडियम क्लोराइड घुलता है। और यह मानने में भी कोई अतिश्योक्ति न होगी कि इतने आयन पानी में मौजूद खाली स्थानों में समा जाएँगे।
रोचक बात तो यह देखना होगा कि क्या अधिकतम सोडियम क्लोराइड घुलने के बाद भी खाली स्थान बचे हैं। इसे देखने का एक तरीका यह होगा कि पहले पानी में सोडियम क्लोराइड का सन्तृप्त घोल बना लिया जाए। फिर देखा जाए कि इसमें शक्कर की घुलशीलता पर क्या असर पड़ता है। यह भी देखा जा सकता है कि नमक के सन्तृप्त घोल में शक्कर घोलने पर आयतन में वृद्धि कब शुरु होती है।
सुशील जोशी: एकलव्य द्वारा संचालित स्रोत फीचर सेवा से जुड़े हैं। विज्ञान शिक्षण व लेखन में गहरी रुचि।

